Каковы преимущества Centella Asiatica?
Центральная Азия, Центральная Азияis the dried whole herb of the plant Centella asiatica (L.) Urb. in the family Apiaceae. It has the effects of clearing away heat and dampness, detoxifying and reducing swelling. It is mainly used to treat damp-heat jaundice, heatstroke diarrhea, stone dysuria, hematuria, carbuncle and swelling caused by toxin, bruises and contusions, etc.[1]. When previous scholars analyzed the chemical composition of Centella asiatica, they found that its main components include triterpenoids, essential oils, polyacetylenes, flavonoids, etc., and triterpenoids are the most abundant [2]. Madecassoside is a triterpenoid compound found in Centella asiatica. Its molecular formula is C48H78O19 and molecular weight is 959.12[3]. As one of the main pharmacologically active ingredients in Centella asiatica, madecassoside has a variety of pharmacological effects, such as anti-tumor, anti-inflammatory, protecting the nervous system, and promoting wound healing[4].

1. Антиопухолевый эффект и механизм экстракта Centella asiatica
1.1. Сдерживает распространение опухолевых клеток
Чжоу и др. [5] показали, что asiaticoside может препятствовать распространению колоректальных раковых клеток путем ингибирования ядерного фактора транскрипции κB (NF-κB) сигнального пути. Кроме того, азитикозид может также препятствовать распространению раковых клеток поджелудочной железы путем ингибирования фосфоризации белка киназы, активированного митогеном (p38MAPK) и NF-κB p65 [6].
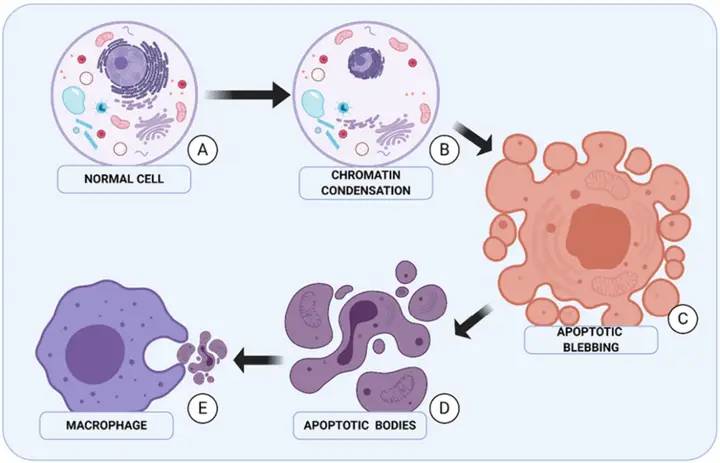
1.2 индуцирование апоптоза в опухолевых клетках
Zeng Manhong et al. [7] использовали различные концентрации asiaticoside для лечения рака желудка SGC-7901 клеток, и клетки показали значительный апоптотический пик. Электронная микроскопия трансмиссии выявила типичные характеристики апоптоза, такие как цитоплазмическая концентрация, атомная усадка и разрыв, митохондриальная агрегация. Экстракт Centella asiatica также способствует апоптозу в клетках рака молочной железы MCF-7: по мере увеличения времени вмешательства экстракта Centella asiatica морфология клеток MCF-7 становится неправильной, цитоплазма постепенно распространяется, ядра сначала взрываются, а затем постепенно исчезают, в конечном итоге формируя апоптотические тела. Дальнейшие исследования показали, что asiaticoside может значительно снизить экспрессивные уровни эндотелиального фактора роста сосудов (VEGF) и основного фактора роста фибробструдов (bFGF) белков в клетках MCF-7 [8]. Wu Qian et al. [9] обнаружили, что различные концентрации азитикозида могут вызывать апоптоз в клетках остеосаркомы sa -2 и могут снизить экспрессионные уровни фосфатилинозитола 3- киназы (PI3K), протеина kinase B (Akt), фосфорилата Akt (p-Akt), гликогена synthase kinase 3β (GSK-3β), что указывает на то, что азитикозид может вызывать апоптоз в клетках остеосаркомы sa -2 β (p-GSK-3β), регулируя деятельность PI3K/Akt/GSK-3β. Другие исследования также показали, что asiaticoside может вызывать апоптоз при раке печени qgi -7703 и Bel-7402 клеток путем подавления активности сигналов PI3K/Akt и MAPK/extracellular signal- регулируемых kinase (ERK) [10].
Bax, относящийся к Bcl-2 X белок, принадлежит к семейству Bcl-2 и является основным регулятором апоптоза в организме человека [11]. Пан джинли [12] обнаружил, что индукция апоптоза а2780 раковых клеток яичников азитикозидом может быть связана с понижением регуляции выражения антиапоптотического фактора БЦЛ -2 и упрегуляцией проапоптотического фактора Bax. Связанные с этим исследования показали, что после 48 часов действия на Рак молочной железы MCF-7 клетки asiaticoside значительно индуцируют апоптоз в клетках, а уровень экспрессии каспаза -3 (c-asiaticoside p-asiaticoside e-3) в клетках значительно повышается, фактор некроза опухоли (TNF-α) и interleukin 1β (IL-1β) значительно снижается [13-14]. Кроме того, Li et al. [15] обнаружили, что asiaticoside может оказывать антиопухолевое воздействие на лекарственные устойчивые клетки миеломы KM3/BTZ. Этот механизм связан с инициированием автомехалогии, активизацией деятельности c-asiaticoside p-asiaticoside e-3 и подавлением миграции клеток, вторжения, а также с преобразователем и активатором сигналов транскрипции 3 (STAT-3). Таким образом, asiaticoside может вызывать апоптоз в клетках опухоли, регулируя выражение белков, связанных с апоптозом, и выступая посредником между связанными с апоптозом сигнальными путями (такими как PI3K/Akt/GSK-3β signal pathway), тем самым препятствуя распространению, миграции и проникжению опухолевых клеток.
2. Антифиброзный эффект и механизм азитикозида
Связанные с этим исследования показали, что, когда массовая концентрация азитикозида составляет 400 градиентов/мл, она оказывает ингибиторное воздействие на эмбриональные фибробласты кожи человека и фибробласты легких человека [16-17]. В ходе эксперимента по мезенхимальному фиброзу легких крыс, вызванного пимекролимусом, было установлено, что азитикосайд улучшил мезенхимальный фиброз легких, вызванный пимекролимусом, путем упрегуления экспрессионного уровня рецепторов аденозин 2а (A2AR) и понижения экспрессионного уровня ил -4, TNF-α и преобразования коэффициента роста beta 1 (TGF-β1) [18]. Жу девей и др. [19] обнаружили, что asiaticoside может препятствовать производству воспалительных цитокинов, снизить уровень экспрессии TGF-β1 mRNA и оказывать антифибротический эффект.
Ван се [20-21] обнаружил, что азитикозид может значительно улучшить фиброз почек у крыс с односторонней уретеральной неспособностью. Механизм может быть связан с понижением регуляции выражения фактора роста соединительной ткани (CTGF) и типа III коллагена (Col III) в почечном интерститии. Кроме того, тот же автор также обнаружил, что asiaticoside может улучшить миокардный фиброз после инфаркта миокарда у крыс. Жао сиксия и др. [22] создали крысу-модель фиброза иммунной печени для изучения воздействия азитикозида на уровни аланниновой аминотрансферазы (ALT) и аспартатной аминотрансферазы (asiaticoside T) в сыворотке крови и гидроксипролайне (Hyp) в тканях печени крысы-модели. Результаты показали, что азитикозид может снизить степень фиброза в тканях печени крыс и значительно снизить уровни альт и азитикозид т в сыворотке и гип в тканях печени крыс, что указывает на благотворное воздействие азитикозида на иммунную фиброз печени. Ji et al. [23] пришли к выводу, что asiaticoside может улучшить фиброз легких, вызываемый bleomycin (BLM) у крыс, и что механизм действия может быть связан с регулированием пути TGF-β1/Smad.
Другое исследование показало, чтоAsiaticoside может значительно снизить степень фиброзаВ легочной ткани мышей с легочным фиброзом модели. А механизмом действия может быть улучшение фиброза легких путем активации циклического аденозинового монофосфата (лагерь)/ р, связанного с аперулозидом белком 1 (рап1), сигнализирующего путь [24]. Чжанг и др. [25] вызывали фиброз легких у мышей дикого типа (WT) и нокаутов A2AR (A2AR-/-) мышей с использованием BLM, а затем изучали эффект вмешательства asiaticoside. Результаты показали, что экспрессионный уровень костного морфогенетического белка 7 (BMP7) и p-Smad1/5 в легочной ткани мышей как WT, так и A2AR-/- мышей был значительно повышен, что позволяет предположить, что азитикозид может уменьшить степень фиброза легких путем упредилирования BMP7/p-Smad1/5, указывающего путь через A2AR. Таким образом, азитикозид может снизить степень фиброза в различных тканях и органах, таких как легкие, печень, почки и сердце. Его механизм действия связан с понижением регулирования TGF-β1, CTGF, ALT, asiaticoside T и выражения Hyp.
3 противовоспалительный эффект и механизм азиатикосайда
NF-κB сигнальный путь тесно связан с воспалительными реакциями и играет важную роль в регулировании клеточных воспалительных реакций. При стимуляции клеток может быть активирован NF-κB, что, в свою очередь, приводит к избыточному подавлению воспалительных факторов ниже NF-κB сигнального пути, таких как TNF- α, IL- 1β, IL-2, IL-6, синтаза оксида азота (iNOS) и циклоксиген -2 (COX-2) [26]. Связанные с этим исследования показали, что, с одной стороны, азиатикосайд может оказывать противовоспалительное действие, препятствуя движению NF-κB сигнальных путей и ограничивая экспрессию оксида азота (NO), TNF-α и ил -6 [27-28]. С другой стороны, asiaticoside может также оказывать противовоспалительное действие, регулируя сигнальный путь гемы оксигеназы 1 (ho1), препятствуя образованию провоспалительных факторов и активности пероксидазы [29].
Таким образом, он может уменьшить воспалительную реакцию, вызываемую гипоксическими состояниями, путем ингибирования сигнального пути NF-κB/p38 [30], и уменьшить воспалительную реакцию, вызываемую гипоксическими состояниями, путем снижения регуляции экспрессии микрорны -155 (мир -155) и упредгуляции экспрессии ингибирующего белка 1 (SOCS1) [31]. Защитное воздействие asiaticoside на инвазионно-амилоидные 1-42 (Aβ1-42) повреждения эндотелиальных клеток может быть достигнуто путем ингибирования высвобождения ил -1, ил -6 и ТНФ - β из эндотелиальных клеток [32]. Также сообщалось, что азитикозид может подавлять аллергическое воспаление мачты при помощи клетчатки, и этот механизм может быть связан с траекторой ижевого рецептора высокой аффинити (FcεRI) [33]. Wu et al. [34] использовали токсин дождевой лягушки для репликации мышечной модели мягкого острого панкреатита для изучения эффекта воздействия азиатикозида. Результаты показали, что asiaticoside может оказывать противовоспалительное действие путем ингибирования пути TLR4 и снижения экспрессионных уровней реактивного белка kinase 3 (RIP3) и фосфорилированного смешанного происхождения kinase domine-содержащего белка (p-MLKL) в поджелудочной ткани. Таким образом, asiaticoside может улучшить различные воспалительные реакции. Его механизм действия связан с ограничением выражения ил -6, ил -1β, и TNF-α in the NF-κB pathway и подавлением окислительного стресса.
4. Анти-альцгеймер' с действие болезни и механизм азиатикосайда
"Альцгеймер энд"#39;s болезнь (AD) является распространенным нейродегенеративным заболеванием характеризуется прогрессирующей когнитивной дисфункцией. Установлено, что патогенез ад связан с воспалительной реакцией, аномальным осаждением гравюра и апоптозом [35].
Согласно литературным отчетам, asiaticoside может облегчить нейровоспаление путем снижения уровня NO и выражения нос mRNA в астроцитах [36]. Cai Pengfei [37] пришел к выводу, что asiaticoside может улучшить повреждения, вызванные повреждением эндотелиальных клеток (HUVEC) в пупочной вене человека, и его механизм действия может быть связан с ингибированием апоптоза и выражением ил -1, ил -6 и TNF- β. В работе Song et al. [38] исследуется влияние азитикозида на интродукционный апоптоз микрососудистых эндотелиальных клеток человеческого мозга (гбокс). Результаты показали, что asiaticoside может ингибировать апоптоз гбмеков, а механизм действия связан с ингибированием траектории сигнала тlr4 /NF-κB, выражением тlr4, коэффициентом дифференциации миелоида 88 (MyD88), фактором рецептора опухоли necrosis factor 6 (TRAF6), p-NF-κB p65 белком, а также с ядерным перемещением NF-κB, а также выражением TNF-α and IL-6.
Экстракт Centella asiatica can regulate the production of Aβ before neuropathy, thereby preventing the occurrence of AD [39]. Centella asiatica extract has a protective effect on HUVEC damage caused by Aβ1-42, and its mechanism of action may be related to up-regulating Bcl-2 expression and down-regulating Bax expression [40]. Xu et al. [41] found that aspertilloside has a significant reversing effect on 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)-induced AD, and its mechanism of action is related to the increase in the Bcl-2/Bax ratio. Aspertilloside also has strong blood-brain barrier penetration and has the potential to treat neurodegenerative diseases [42]. Thus, asiaticoside can improve AD, and its mechanism of action is related to the inhibition of HU-VEC apoptosis, the activity of the TLR4/NF-κB signaling pathway, and the expression of the inflammatory factors IL-1, IL-6, and TNF-α.

5. Эффект и механизм asiaticoside в улучшении обучения и памяти
Centella asiatica extract can improve learning and memory in mice, and its mechanism of action may be related to reducing the deposition of Aβ in hippocampal tissue and upregulating the expression of synaptophysin (SYN) protein [43-44]; it may also be related to upregulating the expression of peroxisome proliferator-activated γ receptor (PPARγ) protein and downregulating the expression of inflammatory factors IL-6, TNF-α, and IL-1 [45]. Related studies have found that asiaticoside also has a good preventive effect on cognitive dysfunction in diabetes, and its mechanism of action may be related to the regulation of oxidative stress and the PI3K/Akt/NF-κB pathway [46].
6. Антидепрессантный эффект и механизм азиатикосайда
Ван и др. [47] использовали модель хронического мягкого стресса (CMS) мышей для изучения антидепрессантного эффекта asiaticoside. Результаты показали, что asiaticoside может оказывать антидепрессантное действие, регулируя сигнальные пути лагеря/белковой киназе A (PKA). Другое исследование показало, что asiaticoside может оказывать антидепрессантное действие, активируя нейротрофический фактор мозга (BDNF), сигнализирующий путь [48]. Hou et al. [49] сравнили антидепрессантные эффекты asiaticoside и asiaticoside-borneol формулы (FAB) и обнаружили, что оба имеют определенный антидепрессантный эффект, причем FAB более эффективен, чем asiaticoside. Фаб также оказывает более значительное влияние на upregulating BDNF и serotonin (5-HT) выражение.
7 эффект и механизм азитикозида в подавлении рубцовой гиперплазии и восстановлении повреждения кожи
Исследования показали, что asiaticoside обладает уникальными преимуществами в предотвращении распространения рубцов и устранении повреждений кожи: с одной стороны, asiaticoside может повысить активность миграции клеток и увеличить скорость заживления ран [50-51]; С другой стороны, asiaticoside может препятствовать распространению фибробласта рубцов и синтезу коллагена, а также распространению рубцов [52]. Эксперименты In vitro показали, что механизм, с помощью которого asiaticoside препятствует распространению рубцевых фибробластов, может быть связан с подавлением выражения белков, участвующих в сигнальных маршрутах RhoA/Rho kinase Ⅰ (RhoA/ROCK Ⅰ) [53], а также может быть связан с ограничением выражения типа I и III collagen и TGF-β1 mRNA [54]. Связанные с этим исследования показали, что в модели рубца кроличьего уха, по мере увеличения времени администрирования, площадь рубца постепенно уменьшается, а механизм действия может быть связан с уменьшенным выражением TGF-β1 [55]. На этой основе Huang et al. [56] также пришли к выводу, что asiaticoside может препятствовать образованию пролипроливных шрамов у кроликов, ограничивая выражение коллагена I и III и ил -1β, ил -6 и ил -8 mRNA, а также упрегуляя выражение Smad7 и PPARγ mRNA, и это зависит от дозы. В другом исследовании было установлено, что причина ингибирования образования шрамов азиатикозидом может быть связана с упрегуляцией выражения белка 47 (HSP47) от теплового удара [57].
У яньвэн [58] создал глубокую модель ожоговых крыс второй степени и вмешался с азиатикосайдом. Результаты показали, что уровень проявления циклона и распространяющегося клеточного ядерного антигена (пхна) в тканях кожи крыс был повышен. В то же время азиатикосайд может сдерживать чрезмерную воспалительную реакцию, препятствуя ядерному переносу белка NF-κB p65, тем самым способствуя заживлению ран и сокращая время заживления. Чжу и др. [59] пришли к выводу, что коаксиальные нановолокна, нагруженные азитикозидом, могут способствовать заживлению глубоких ожоговых ран второй степени у крыс путем упредиления экспрессии вегф, пхна и молекул адгезии эндотелиальных клеток (CD31) и ослабления регулирования экспрессии TNF-α и IL-6. Кроме того, роль asiaticoside на разных стадиях раневого ремонта различна: он может способствовать распространению рубцов на стадии раневого ремонта, но препятствовать образованию рубцов на пластиковой стадии раневого ремонта [60]. Другое исследование показало, что asiaticoside может также способствовать производству моноцитного химико-протеина 1 (MCP-1) для содействия заживлению ран [61].
Nie et al. [62] found that the asiaticoside complex can reduce the inflammatory response in the wound of rats with diabetic skin ulcers (DCU) model, inhibit bacterial growth in the wound, promote wound healing, and upregulate the expression of VEGF, iNOS, endothelial nitric oxide synthase (eNOS) and CD34. The mechanism of action is related to downregulating the Wnt/β-catenin signaling pathway. Free skin flaps are a common means of skin burn and surgical repair. A skin flap is selected according to the skin defect, an area similar to the damaged skin is selected, and the flap is then transferred to the defect area for repair to achieve the purpose of repairing the skin defect [63]. A study found that asiaticoside can increase the survival area of skin flaps in rats, and the mechanism of action may be related to up-regulating the expression of superoxide dismutase (SOD) and VEGF and down-regulating the expression of inflammatory factors [64]. It has also been found that Centella asiatica-sodium alginate repair patches [65] and Centella asiatica nanoemulsions [66] prepared from asiaticoside have a good repair effect on skin damage.
Это показывает, что asiaticoside может подавлять рубцовую гиперплазию и восстанавливать повреждения кожи. Его механизм действия связан с подавлением выражения коллегена типов I и III и TNF-α, ил -6 и ил -1β, а также деятельностью Wnt/β-catenin сигнальной дорожки, и упрегуляцией выражения TGF-β1, VEGF, iNOS и MCP-1.
8. Улучшающий эффект и механизм азитикозида на повреждение печени, легких и почек
Исследования показали, что азитикозид оказывает благоприятное воздействие как на вызванные сепсисом повреждения легких, так и на острую почечную травму при сепсисе. С одной стороны, asiaticoside может подавлять активность MAPK и NF-κB сигнальных путей путем упрегуляции PPAR-γ экспрессии, тем самым уменьшая повреждения легких [67]. С другой стороны, centella asiatica saponin может улучшить повреждение почек путем понижения регуляции выражения ил -6 в сыворотке и выражения иноса белка в почечной ткани [68]. Чжанг и др. [69] использовали мышь-модель липополисахарида/д-галактозамина, вызванную повреждением печени, и вмешались в дело centella asiatica saponin. Результаты показали, что ПГС может улучшить повреждение печени, препятствуя выражению TNF-α и MAPK. Кроме того, Wang et al. [70] обнаружили, что псу может улучшить почечную повреждение у крыс с болезнью почек, и этот механизм может быть связан с упрегуляцией выражения mRNA синаптофина, эндорфинов и пододина, а также с ограничением выражения mRNA конъюнктурного белка.
Данг и др. [71] изучали влияние азитикозида на улучшение повреждений легких, вызванных гипераксией, посредством экспериментов in vitro и in vivo. Результаты показали, что asiaticoside может снизить уровни миелопероксидазы (MPO) и малодиалдегида (MDA) в сыворотке крыс с моделями повреждения легких, а также уровни TNF-α, IL-1β и IL-6, а также повысить общий уровень антиоксидантной способности (TAOC), чтобы оказать влияние на улучшение повреждения легких крыс. Дальнейшие эксперименты in vitro с использованием альвеолярных клеток типа II (AEC II), изолированных от тканей легких крыс, показали, что asiaticoside может значительно ингибировать апоптоз клеток AEC II. Механизм действия может быть связан с опережением выражения ядерного фактора э2 - фактора 2 (Nrf2) и ho1. Таким образом, азитикозид может улучшить повреждение печени, легких и почек, а его механизм действия связан с подавлением окислительного стресса и воспаления и улучшением антиоксидантной способности.
9 прочие расходы
Связанные с этим исследования показали, что asiaticoside может быть использован для предотвращения повреждения ДНК, вызванного облучением: после радиационной обработки мышей, обработанных asiaticoside, повышены показатели выживаемости и уровни TAOC сыворотки, уровни TGF-β1 были снижены, а механизм действия может быть связан с повышенной антиоксидантной мощностью [72]. Luo et al. [73] исследовали влияние азитикозида на вмешательство крыс с травмой спинного мозга (SCI) модели. Результаты показали, что уровни ино, TNF-α, IL-1β, IL-6 и NF-κB p65 в сыворотке крыс были снижены, а уровни MDA, SOD, пониженные уровни глутатиона (GSH) и глутатиона пероксидазы (GSH- px) повышены. Дальнейшие исследования показали, что уровень проявления p38MAPK в тканях спинного мозга крыс значительно снизился, что указывает на то, что asiaticoside может улучшить повреждения спинного мозга крыс с помощью антиоксидантов, противовоспалительных средств и ингибирования p38MAPK, подающих признаки. Вентилятор и др. [74] обнаружили, что акорбосайд может восстанавливать моторную функцию у крыс с SCI и улучшать повреждения нейронов спинного мозга. Механизм действия связан с уменьшением экспрессии TNF-α и c-ascorboside p-ascorboside e-3 белка в ткани спинного мозга. Eka et al. [75] исследовали гипогликемическое воздействие аскорбозида на диабетических мышей. Результаты показали, что после вмешательства с азитикозидом уровень глюкозы в крови и гликозилированного гемоглобина у мышей диабетической модели снижается, а уровень инсулина повышается, что говорит о Том, что азитикозид может оказывать хорошее терапевтическое воздействие на диабет.
10. Выводы
В последние годы, с углублением исследований по азитикосайду учеными внутри страны и за рубежом, основные фармакологические эффекты и механизмы азитикосайда были первоначально прояснены: азитикосайд может оказывать антиопухолевые эффекты, подавляя распространение опухолевых клеток и вызывая апоптоз опухолевых клеток; Он может оказывать антифиброзное воздействие путем понижения уровней TGF-β1, CTGF, ALT, asiaticoside T и Hyp уровней, он оказывает антифиброзное воздействие; Оказывает противовоспалительное действие путем понижения регуляции экспрессии ил -6, ил -1β, и ТНФ -α в NF-κB сигнализируя путь и препятствуя окислительному стрессу; Оказывает антиад-эффект путем ингибирования сосудистого эндотелиального клеточного апоптоза, активности тlr4 /NF-κB сигнального пути, а также проявления воспалительных факторов ил -1, ил -6 и тn -α; Оказывает антирекламное действие, препятствуя выражению типов I и III collagen и TNF-α, IL-6, IL-1β expression and Wnt/β-catenin signal pathway activity, upregulate TGF-β1, VEGF, iNOS, MCP-1 expression, и играет определенную роль в подавлении шрамной гиперплазии и восстановлении повреждения кожи; Выполняя роль посредника в пути сигнала MAPK/NF-κB, ингибирует MDA, iNOS, TNF-α, ил -6 выражение и улучшает антиоксидантную способность, оказывая влияние на улучшение повреждения печени, почек и легких.
В настоящее время большинство исследований по asiaticoside'. Антиопухолевые эффекты s концентрируются на молекулярных механизмах клеток in vitro, в то время как фармакологические исследования, основанные на экспериментах in vivo, отсутствуют. Поэтому последующие исследования по борьбе с опухолями могут быть сосредоточены на моделях животных. Кроме того, исследование asiaticoside's anti-inflammatory and anti-fibrosis effects most of the research focuses on the expression of related proteins, lacking research on the mechanism of action of specific signal pathways. Therefore, subsequent research can be conducted on the pharmacological effects and mechanisms of Centella asiatica extract from the perspective of signal pathways.
Ссылки на статьи
[1] Национальная комиссия по фармакопее. Фармакопея людей и#39; китайская республика: часть I [и]. Издание 2020 года. Пекин: China Medical Science and Technology Press, 2020: 296.
[2] Weng Xiaoxiang, Huang Wenwu, Kong Deyun. Прогресс в исследовании тритерпеноидных компонентов и фармакологической деятельности Centella asiatica [J]. Китайский журнал фармацевтической промышленности, 2011, 42 (9): 709-716.
[3] ли янан, ли чжихуэй, хуо лини и др. Исследование химического состава centrella asiatica[J]. Традиционная китайская медицина гуанси, 2015, 38(2): 78-80.
[4] DING Y, ZHANG Z, WANG S. прогресс в исследованиях asiaticoside[J]. Шижэнь национальная медицина, 2016, 27(3): 697-699.
[5] Чжоу X, KE C L, LV Y, и др. Asiaticoside подавляет распространение клеток путем ингибирования NF-κB сигнального пути в колоректальном раке [J]. Int J Mol Med, 2020, 46(4):
1525-1537.
[6] HE Y G, PENG X H, ZHENG L, et al. Asiaticoside подавляет эпителиально-мезенхимальный переход и свойства стволовых клеток поджелудочной железы PANC-1, блокируя активацию p65 и p38MAPK[J]. J Gastrointest Oncol, 2021, 12(1): 196-206.
[7] Zeng Manhong, Chen Lingfeng. Исследование влияния азитикозида на линию рака желудка человека SGC-7901 [J]. Журнал колледжа традиционной китайской медицины цзянси, 2011, 23(6): 57 — 59.
[8] лю ченшу, цинь сида, сюй тао и др. Влияние азитикозида на апоптоз и уровни экспрессии белка VEGF и bFGF в клетках рака молочной железы MCF-7 [J]. Достижения в современной биомедицине, 2018, 18(7): 1314 — 1317.
[9] у цянь, цзян бо. Влияние азитикозида на апоптоз клеток остеосаркомы человека Saos-2 [J]. Современная медицина и клиника, 2019, 34(8): 2262 — 2267.
[10] MA Y, WEN J, WANG J, et al. Asiaticoside противостоит распространению и химиотерапевтической лекарственной устойчивости клеток гепатоцеллюлярной карциномы (HCC) [J]. Med Sci Monitor, 2020, 26: e924435.
[11] янь лянцзюнь. Bcl-2, бакс и апоптоз опухолевых клеток [J]. Китайский журнал раковой биотерапии, 2003, 3 (3): 232-234.
[12] Пан цзиньли. Исследование механизма азитикозидного индуцирующего апоптоза клеток рака яичников а2780 [J]. Журнал традиционной китайской медицины, 2018, 33(4): 521 — 524.
[13] AL-SAEEDI F J. исследование цитотоксичности азитикозида на крысах и раковых клетках [J]. BMC Cancer, 2014, 14(1): 220.
[14] AL-SAEEDI F J, BITAR M, PARIYANI S. воздействие asiaticoside на 99mTc- тетрофосмин и 99mTc — поглощение сестамиби в MCF — 7 клеток [J]. J Nucl Med Technol, 2011, 39 (4): 279-283.
[15] Li Y C, WANG H H, ZHANG R, et al. Антиопухолевая активность asiaticoside против множественных миеломоустойчивых к лекарственным препаратам раковых клеток осуществляется при помощи аутомеханической индукции, активации каспазов воздействия, а также подавления клеточной миграции, вторжения и сигнальных путей stat3 [J]. Мгу монит, 2019, 25: 1355 — 1361.
[16] цзы луйю. Воздействие азитикозида и медрессозида на эмбриональные фибробласты человека in vitro [D]. Тайюань: шаньси медицинский университет, 2012.
[17] цянь синцзя. Экспериментальное исследование воздействия матрина и азитикозида на фиброблаты легких человека [D]. Наньцзинь: наньцзинский университет традиционной китайской медицины, 2012 год.
[18] е вэньцзинь, чжу сяочунь, ван сяобин и др. Asiaticoside смягчает вызванный бракоразвалом мезенхимальный фиброз легких путем ингибирования воспаления и фиброза [J]. Китайский журнал фармакологии и токсикологии, 2016, 30 (1): 29-37.
[19] чжу дьюэй, шэнь юньхуэй. Защитное воздействие азитикозида на микофенолатный фиброз легких, вызываемый мофелем, у мышей [J]. Журнал шанхайского университета традиционной китайской медицины, 2020, 34 (6): 41 — 46.
[20] ван се. Исследование воздействия азитикозида на фиброз почек у крыс с односторонней уретеральной непроходимостью [J]. Клинические исследования китайской медицины, 2017, 9(20): 1-4.
[21] ван се. Экспериментальное исследование воздействия азитикозида на миокардный фиброз у крыс с инфарктом миокарда [J]. Китайский журнал биохимических препаратов, 2014, 34(8): 19-22.
[22] чжао сиксия, чжан руцонг, ян субэй. Исследование воздействия азитикозида на иммунный фиброз печени у крыс [J]. Китайский журнал современной прикладной фармации, 2017, 34(5): 666-670.
[23] чжи цзиян, сюй ти. Защитное действие азитикозида на вызываемый блемицином фиброз легких у крыс [J]. Современная медицина, 2014, 42 (11): 1304 — 1309.
[24] Лу дж., чжан т., чжу с., и др. Asiaticoside может смягчить вызываемый блеомицином фиброз легких, активировав лагерь и сигнальный путь RAP1 с помощью A2AR [J]. J Cell Mol Med, 2020, 24(14): 8248-8261.
[25] чжан т, дай й й й, и др. Азитикозид смягчает вызываемый цветом фиброз легких у мышей A2AR-/- путем продвижения сигнального пути BMP7/Smad1/5 [J]. Biochem Biophys Res Commun, 2020, 527(3): 662-667.
[26] го лимин, Lv Jieli, чжан лайбин. Прогресс в исследовании противовоспалительного механизма природных сескитерпеноидов [J]. Китайский журнал традиционной китайской медицины, 2018, 43(20): 3989 — 3999.
[27] линху ланг, цзя ё йцзин, чэнь цзин и др. Влияние азитикозида на липополисахаридные воспалительные повреждения в астроцитах [J]. Журнал зуньи медицинского колледжа, 2018, 41(2): 160 — 164.
[28] цзян чэнчэн, чжао хенгуан, у ямей. Влияние азитикозида на липополисахаридовую активацию ядерного транскрипционного коэффициента κB и воспалительную реакцию в клетках RAW264.7 [J]. Китайский журнал респираторной и критической медицины, 2010, 9 (4): 422-425.
[29] WAN J Y, GONG X, JIANG R, et al. Антипиретические и противовоспалительные эффекты азитикозида у липополисахаридов-обработанных крыс через повышение регуляции гемы оксигеназа -1 [J]. Фото: Phytother Res, 2013, 27(8): 1136-1142.
[30] чжан т, цай чж, ян л и др. Асперулосид снижает гипоксическую легочную гипертензию у мышей путем ингибирования пути NF-κB/p38. Китайский журнал патологической физиологии, 2019, 35(9): 1600-1607.
[31] MAI L J, FU X X, HE G, et al. Влияние азитикозида на бронхопулмональную дисплазию, вызываемую гипероксией, у новорожденных крыс и соответствующего механизма [J]. Чжунго данг дай ер ке за чжи, 2020, 22(1): 71-76.
[32] чжан ц, чэнь л джей, сунь и х и др. Влияние азитикозида на выражение воспалительных факторов в эндотелиальных клетках, вызванных гравитацией 1-42 [J]. Китайский журнал биохимических препаратов, 2015, 35(1): 46-48.
[33] JIANG J Z, YE J, JIN G Y, et al. Asiaticoside смягчает аллергическое воспаление путем отмены дегрануляции мачт-клеток [J]. J Agr Food Chem, 2017, 65(37): 8128 — 8135.
[34] WU K Y, YAO G H, SHI X L, et al. Азиятикозидные амелиораты ацинарного клеточного некроза при остром панкреатите через платный рецептор 4 пути [J]. Мол иммунол, 2020, 130: 122 — 132.
[35] лю чанг, Мэн сяньонг, дун сяохуа. Патогенез альцгеймера#39;s болезнь и прогресс в исследованиях терапевтических препаратов [J]. Журнал нейрофармакологии, 2020, 10(4): 36 — 40.
[36] мо жукай, ин на, сюй чанлян и др. Влияние asiaticoside на освобождение воспалительных посредников от индуцированных градом астроцитов [J]. Zhejiang Traditional Chinese Medicine Journal, 2012, 47(11): 835-837.
[37] CAI P. эффекты и механизм азитикозида при индуцированном 1-42- й гранью повреждении эндотелиальных клеток [D]. Лучжоу: лучжоу медицинский колледж, 2014.
[38] песня D, JIANG X, LIU Y, et al. Asiaticoside ослабляет ингибирование роста клеток и апоптоз, вызываемый действием 1- 42, посредством ингибирования TLR4/NF- β B сигнализирующего пути в микромозговых микроv аскулярных эндотелиальных клетках [J]. Передняя аптека, 2018, 9: 28.
[39] хоссейн с, хасимото м, катакура м и др. Лекарственное значение азитикозида для альцгеймера#39; болезнь s, оцениваемая с помощью одномолекулярной спектроскопии корреляции флуоресценции, лазерной сканирующей микроскопии, электронной микроскопии передачи и силикостыковывания [J]. BMC дополнение Altern Med, 2015, 15(1): 118.
[40] чжан ц, цай п, чжоу дж., и др. Влияние азитикозида на эндотелиальный апоптоз клеток пуповинной вены человека, вызванный гравитацией 1-42 [J]. Int J Clin Exp Med, 2015, 8(9): 15828-15833.
[41] сюй с л, ван к з, сунь лм и др. Asiaticoside: ослабление нейротоксичности, вызываемой MPTP в крысиной модели паркинсонизма путем поддержания баланса редокса и регулирования соотношения Bcl-2/Bax [J]. Фармакол биохем бехов, 2012, 100(3): 413-418.
[42] ханапи н а, мохамад а с, абдулла дж., и др. Кроветворно-мозговой барьер проницаемости азитикозида, медрессозида и азиатской кислоты в эндотелиальной клеточной модели свиного мозга [J]. J Pharm Sci, 2020, 110(2): 698-706.
[43] ин н, инь ЦЗЬ, ю х и др. Влияние asiaticoside на когнитивные функции мышей с диабетом [J]. Zhejiang Journal of Integrated Traditional and Western Medicine, 2014, 24(3): 203-206, 184.
[44] ван сяоцзин, ван дунсин, сюй чуньпин и др. Лечебное воздействие азитикозида на альцгеймер#39; болезнь s [J]. Китайский журнал фармацевтических наук, 2016, 6(13): 37-39, 92.
[45] HUANG Y L. корреляция между спариванием и выражением воспалительных факторов после внутрибрюшной инъекции 1-42 у крыс и исследование вмешательства азитикозида [D]. Лючжоу: юго-западный медицинский университет, 2017.
[46] йинь ЦЗЬ, юй й, чэнь с и др. Asiaticoside смягчает вызванные диабетом нарушения когнитивных способностей путем регулирования PI3K/Akt/NF-κB пути [J]. Риз головного мозга бегева, 2015, 292: 288 — 299.
[47] WANG L Q, GUO T, GUO Y F и др. Asiaticoside производит антидепрессантный эффект в хроническом непредсказуемом мягком стрессовом моделировании депрессии мышей, включая обращение вспять воспаления и сигнальный путь PKA/pCREB/BDNF [J]. Mol Med Rep, 2020, 22(3): 2364-2372.
[48] Лу л, лю х л, му р ч и др. Гиппокампал BDNF сигнализация восстановлена с хроническим азитикозидным лечением у депрессивных мышей [J]. Брейн Res Bull, 2015, 114: 62 — 69.
[49] HOU T H, LI X B, PENG C S. Borneol усиливает антидепрессантные эффекты Asiaticoside, способствуя его распространению в мозгу [J]. Нейроски летт, 2017, 646: 56 — 61.
[50] WARINTORN R, CHIRANAN K и др. Извлечение депигментальной центеллы asiatica путем предварительной обработки сверхкритической жидкостью диоксида углерода для заживления ран [J]. Процессы, 2020, 8(3): 277.
[51] LEE J H, KIM H L, LEE M H и др. Asiaticoside улучшает нормальную миграцию клеток кожи человека, их прикрепление и рост в пробирках модели заживления ран [J]. Фитомедицин, 2012, 19(13): 1223-1227.
[52] оуян данвей, шао ян, конг дейюн и др. Ингибиторное воздействие азитикозида и его химических компонентов на распространение рубцовых фибробластов [J]. Мировые клинические препараты, 2014, 35(4): 215 — 220.
[53] дай либин, Пан шу, шэнь ян и др. Влияние азитикозида на фактор роста соединительной ткани и регулятивные сигналы RhoA/ROCK-I в пролиферативных рубцовых фибробластах [J]. Китайский фармацевтический журнал, 2010, 45 (14): 1067 — 1072.
[54] ли шаньшань. Влияние asiaticoside на распространение рубцовых фибробластов и экспрессию коллагена и TGF-β1 mRNA [D]. Ухань: Hubei University of Traditional Chinese Medicine, 2011.
[55] чжоу цзы, сян у, хуан х и др. Эффекты asiaticoside на коллагеновые волокна и TGF-β1 выражение в пролиферативной рубцовой ткани кроличьих ушей [J]. Китайский журнал эстетической медицины, 2015, 24(21): 32-37.
[56] HUANG J, ZHOU X B, XIA L L, et al. Ингибирование образования гипертрофического рубца с пероральным азитикосайдным лечением в модели рубца кроличьего уха [J]. Int ran J, 2021 [2021-06-12].
[57] HU R, JIANG R. эффекты азитикозида на заживление ран и выражение белка теплового удара 47 в образовании шрамов у крыс с ожогами [J]. Zhejiang Medical Journal, 2020, 42(1): 36-38, 101.
[58] у ю. исследование механизма азитикосайда при лечении ожоговых ран [д]. Наньцзинь: наньцзинский университет традиционной китайской медицины, 2019 год.
[59] чжу л ф, лю х у, дю л и др. Подготовка азиятикози-разгружаемых углеродно-электроспираливающихся нановолокон и их воздействие на ожоги большой толщины [J]. Biomed Pharmacother, 2016, 83: 33 — 40.
[60] чэнь л, ван т, лю м и др. Влияние азитикозида на вмешательство на различных стадиях восстановления ран и иммуногистохимическое выражение трансформирующего фактора роста β1 и Smad3 в ранах крольчатого уха [J]. Традиционная китайская медицина хэбэй, 2019, 41(10): 1532-1535, 1539.
[61] HOU Q, LI M, LU Y H и др. Ожоговые свойства заживления ран Asiaticoside и madec Assoside [J]. Exp Ther Med, 2016, 12(3): 1269-1274.
[62] NIE X U, ZHANG H, SHI X J, et al. Гель оксида азота Centella asiatica iaticoside ускоряет заживление кожных диабетических язв путем активации сигнального пути Wnt/β-catenin [J]. Инт иммунофармакол, 2020, 79: 106109.
[63] CHENG X F, WANG Z Y. применение местных заслонков кожи при устранении дефектов кожи лица [J]. World recent Medical Information Digest, 2017, 17(11): 53.
[64] FENG X G, HUANG D, LIN D S и др. Эффекты Asiati — косайд-лечение на выживание случайных вспышек кожи у крыс [J]. J Invest Surg, 2021, 34(1): 107-117.
[65] го цзяки, го миньхуэй, конг сончжи и др. Подготовка пластыря по ремонту альгината цинтеллы asiatica glycoside- натрия и его эффект по ремонту ран [J]. Китайская травяная медицина, 2020, 51(19): 4934-4942.
[66] PENG Q, LI J Y, LI H M, et al. Подготовка и оценка качества азитикозидных наномилл [J]. Китайский журнал новых лекарств, 2019, 28(10): 1276-1280.
[67] чжан лэн, чжэн джей джей, чжан л и др. Защитное воздействие азитикозида на септические повреждения легких у мышей [J]. Exp Toxicol Pathol, 2011, 63(6): 519-525.
[68] чжэн дж., чжан л н, у м., и др. Защитный ef- выводит азиатикозиды при вызванной сепсисом острой травме почек у мышей [J]. Чжун го чжун яо за чжи, 2010, 35(11): 1482 — 1485.
[69] чжан л, ли х з, гун х и др. Защитное воздействие азитикозида на острые повреждения печени, вызванные липополисаком-харидой/д-галактосамином у мышей [J]. Фитомедицин, 2010, 17(10): 811 — 819.
[70] WANG Z, LIU J T, SUN W S. эффекты азитикозида на уровни подоцитоскелетных белков и почечных диафрагменных белков в вызываемой адриамицином нефропатии крыс [J]. Life Sci, 2013, 93(8): 352 — 358.
[71] DANG J W, LEI X P, LI Q P, et al. Asiaticoside смягчает вызванные гипоксией повреждения легких in vitro и in vivo [J]. Иран J Basic Med Sci, 2019, 22(7): 797-805.
[72] шэнь х и, чжу ф, ли джей с и др. Защитное воздействие азитикозида на ингибирование распространения под воздействием радиации и повреждение ДНК фибробластов и смерти мышей [J]. Открытая жизнь Sci, 2020, 15(1): 145-151.
[73] Лу и, фу с ф, ван зи и др. Asiaticoside смягчает последствия повреждения спинного мозга через антиоксидантные и противовоспалительные эффекты, а также подавление механизма p38-MAPK [J]. Mol Med Rep, 2015, 12(6): 8294-8300.
[74] вентилятор L, LI X B, LIU T. Asiaticoside ингибирует нейрональный апоптоз и способствует функциональному восстановлению после повреждения спинного мозга у крыс [J]. J Mol Neurosci, 2020, 70(12): 1988-1996.
[75] EKA F, ELIN Y S, ELFAHMI E, et al. Антидиабетическая активность экстракта фракций и асатикозида соединения, изолированного от Centella Asiatica Linn. Листья у мышей, вызванных аллоксом [J]. Asia J Pharm Sci, 2017, 10(10): 268 — 272.


 Английский язык
Английский язык Французский язык
Французский язык На испанском языке
На испанском языке Русский язык
Русский язык Корейская народно-демократическая республика
Корейская народно-демократическая республика На японском языке
На японском языке








