Исследование редкого женьшеня Rg1 Rb1
Женьшень (Организация < < панакс > >женьшень C- да. A. Meyer) is a perennial herb В случае необходимостиВ настоящее времяfamily Araliaceae иis a traditional precious Chinese medicine. Женьшень (женьшень)are one Соединенные Штаты америкиВ настоящее времяmaВ случае необходимостиactive ingredients Соединенные Штаты америкиginseng. They belong to the group Соединенные Штаты америкиtriterpenoid glycosides иare formed По запросу:the condensatiПо состоянию наСоединенные Штаты америкиa sugar иa glycoside precursor. Studies have shown that Женьшень (женьшень)have a variety Соединенные Штаты америкиpharmacological effects [1-3]. After oral administration, most protopanaxadiol-type Женьшень (женьшень)are hydrolyzed by intestinal flora to Женьшень (женьшень)C-K, Rg3, Класс r2and PPD. Д.[4-5], and protopanaxatriol-type ginsenosides are mainly degraded to ginsenoside F1 and 20(S)-PPT[6- 7]. The metabolite C-K Соединенные Штаты америкиprotopanaxadiol-type ginsenosides has significant antitumor activity in vitro and in vivo, and В его рамкахactivity is enhanced compared to the precursor[8]. Rg1, Re and 20(S)-PPT have a strong anti-tumor 1. Ячейкаmetastasis effect after oral administration, while only 20(S)-PPT has an anti-tumor effect when administered intravenously, indicating that the anti-tumor metastasis effect of Rg1 and Re after oral administratiПо состоянию наis produced by their metabolite 20(S)-PPT [9].
Большое количество исследований показало, что женьшень деглюкозилируется кишечными бактериями, чтобы производить редкие женьшень с двумя или одним гликозидным соединением, которые имеют более сильную биологическую активность [10].

Биотрансформация может изменить химическую структуру женьшеня, эффективно улучшить in vivo использование женьшеня, оптимизировать клиническую эффективность препарата, снизить неблагоприятные реакции [11]. Биоконцентрация женьшеня включает изменения в гликозилации, гидроксилации и двойных связей. Глюкозилляция женьшеня происходит главным образом при C-3, C-6 и C-21, включая гликозилгидролиз и гликозилляцию; Некоторые преобразования происходят также на боковых цепях с -3, с -12 и с -17, соединяющих метиловые и гидроксиловые группы; Модификация двойных облигаций связана главным образом с добавлением или окислением двойных облигаций C-24/C-25. В этой статье рассматривается развитие микробной биотваренции редких женьшеня в последние годы, структурные изменения головного ядра и применения его производных, в надежде обеспечить теоретическую основу для структурных исследований и применения женьшеня и их производных.
1 структура и применение редкого женьшеня
1.1 структура редкого женьшеня
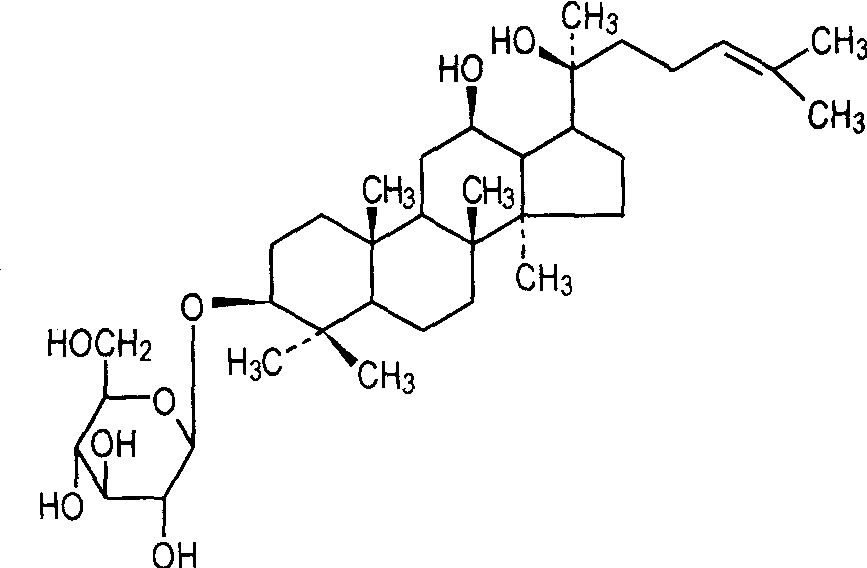
Женьшень подразделяется на тетрациклические тритерпеноиды и пентациклические тритерпеноиды в соответствии со структурой агликона. Женьшень протопанаксадиола типа (рис. 1а) и женьшень протопанаксатриола типа (рис. 1в) имеют оба вида тетрациклического тетрациклического тритерпеноида женьшеня типа, окситироны типа сапонин (рис. 1с) представляют собой тип тетрациклического тритерпеня сапонина с боковой цепью, содержащей кольцо фурана; Сапонины типа олеанана с олеанолиевой кислотой в качестве базового ядра относятся к пентациклическому тритепену сапонину (рис. 1).
Название "редкие женьшень" происходит от того факта, что они естественным образом присутствуют в низких или почти несуществующих количествах. Редкие женьшень в основном дамасские сапонины, имеющие не более трех сахарных соединений, прикрепленных к позициям C-3, C-6 и C-20 aglycone, и не более двух сахарных соединений, прикрепленных к одной позиции. Редкие женьшень получают главным образом путем деглицезилирования или обезвоживания женьшеня. В настоящее время основными выявленными редкими женьшеньками являются Rg3, Rg1, Rh1, Rh2, Rh3, RT3, F1, F2, C-K, PP- д,PPT и т.д., как показано в таблице 1.
1.2 применение редких женьшень сапонинов
Редкие случаи заболеванияginseng saponins are mainly found in red ginseng and black ginseng, and are the basis of the physiological activity of red ginseng and black ginseng, which is different Из российской федерацииthat of ginseng. Порошок женьшеня and ginseng tablets sold on the markВ то же времяonly grind the raw materials (ginseng, American ginseng, etc.) from which ginseng saponins are extracted В Том числе:powder, or add excipients and then press into tablets. Ginseng saponin tablets and capsules only extract the total ginsenosides from the medicinal herb, without further separation or transformation. This directly extracted ginsenoside needs to be broken down by specific enzymes before it can be absorbed by the body. However, these enzymes are either rare or absent in the human body. This results in low bioavailability and weak pharmacological effects in the human body.
В настоящее время большинство редких женьшеновых препаратов в китае содержат мономерные компоненты Rh2 или Rg3. Препараты, содержащие только Один вид мономера женьшеня, показаны в таблице 2.
Common rare ginsenosides such as ginsenoside C-K, Rg3 and Rh2 have been used in clinical applications to improve the body's иммунное здоровье или в сочетании с другими препаратами для адъювантной терапии. Между тем, прикладные исследования редких женьшень по-прежнему является важной частью женьшень развития. Используя 20(R) женьшень в качестве сырья, исследователи синтезировали новую производную женьшень глицинат через реакцию эстерификации между позицией с -3 и трет-бутоксикарбонилглицином. И установлено, что антиопухолевая активность этого производного более чем в 100 раз выше, чем у 20(R) женьшеня (IC50 > 30 mmol/L). Ингибиторный эффект in vivo A11 более значителен, чем ингибиторный эффект 20(R) женьшеня (P < 0,01). В то же время доза а11 надежно сдерживает распространение, миграцию и вторжение клеток HeLa и способствует апоптозу [12]. Женьшень Rg4 является редким женьшень найти в женьшень листья и черный женьшень. Rg4 подавляет воспаление и оказывает защитное действие против сепсиса, вызванного ПМС [13]. Rg5 образует стабильный комплекс с человеческим пуринергическим рецептором 12 (P2RY12) через аллостерические взаимодействия, снижая его активность через остатки E188 и R265, что приводит к снижению выпуска интерлейкина (IL)-6, ил -1 гравюра и некроза опухоли-гравюра в плазме крови, улучшая воспалительную реакцию при препятствовании образованию венозного тромби [14]. Женьшень Rk1 имеет противоопухолевое действие [15], регулирует уровень сахара в крови [16-17], защищает нервную систему [18-19], а при использовании в сочетании с женьшеносидом Rk5 способствует дифференциации и росту остеообласти путем повышения активности щелочного фосфатаза, тем самым лечая остеопороз [20]. По мере развития исследований будут обнаруживаться новые виды биологической деятельности редких женьшень и их производных.

2 состояние исследований биотрансформации редких женьшень
The main methods of ginsenoside transformation are chemical transformation and biotransformation. Chemical transformation mainly uses reactions such as acid-base hydrolysis of glycosidic bonds, oxidative addition and acetylation to change substituents. B. биотрансформацияuses microbial cells to modify the structure of exogenous substrates, and uses one or more enzymes produced during metabolism to catalyze reactions on specific parts (groups) of the substrate, thereby increasing the content and medicinal properties of the active ingredients [21]. Bioconversion methods include bacterial transformation, intestinal flora transformation, fungal transformation and in vitro enzyme catalysis, which make up дляthe shortcomings of chemical transformation methods, such as drastic reaction conditions, environmental pollution and the generation of by-products. They are widely used in research and production. The main reaction types of B. биотрансформацияinclude glycoside hydrolysis reactions and redox reactions [22], among which glycoside hydrolysis reactions are the most widely used [23]. In recent years, the addition reaction at the C-24 and C-25 positions has also been gradually applied in practical production.
2.1 гликозидный гидролиз редких женьшеня сапонина
2.1.1 микробный гликозидный гидролиз женьшеня сапонина
The metabolic pathway of ginseng saponins in vivo is an Важное значение имеетpart of the research on the structure-activity relationship of ginseng saponins. Stepwise deglycosylation is the main metabolic pathway of ginseng saponins in vivo. The rare ginseng saponins and aglycones produced by metabolism have significant pharmacological effects in the body. The main transformation products of ginsenoside Rd were found to be F2, Rg3, C-K, Rh2 and PPD; the main transformation products of ginsenoside F2 were C-K and PPD; the main transformation products of ginsenoside Rg3 are Rh2 and PPD[24]; and C-K and Rh2 can be converted to PPD[25]. Through the analysis of the transformation products of protopanaxatriol-type saponins Re, Rg1, Rh1, Rf, F1 and R1 in the human intestinal flora, their metabolites and transformation pathways were determined i.e., the conversion pathway of ginsenoside Re is Re →Rg1/Rg2 →Rh1/F1 →PPT; the conversion pathway of ginsenoside Rg1 is Rg1 →Rh1/F1 →PPT; the conversion pathway of ginsenoside Rf is Rf→Rh1 →PPT; and the metabolic pathway of notoginsenoside R1 is R1 →Rg1/Rg2 →Rh 1 →PPT[26].
Метаболический путь женьшеня Rb1 - Rb1кишечными бактериями in vitro — это процесс деглюкозиляции, а гидролиз женьшеня Rb1 кишечными бактериями in vitro — это также поэтапный процесс деглюкозиляции [27]. То же самое верно для женьшенового метаболизма кишечных бактерий в vivo. GUO В то же время- эл. - привет.[28] использовали антибиотики широкого спектра спектра для построения модели крыс без микроорганизмов и проверяли преобразование нотожензенга сапонинов (1,535 г/кг) микробиоты кишечника крыс. Результаты показали, что четыре метаболита женьшеносида женьшеносида F1, Rh2, C-K и PPT были обнаружены в плазме крыс без микробов, но не в плазме крыс с положительным микроорганизмом. Таким образом, предполагается, что основной закон женьшенового метаболизма в vivo является tetraglycoside → trisaccharide → disaccharide → monosaccharide → aglycone.
В микроорганизмах присутствует множество типов ферментов, способных преобразовывать гликозиды [29]. В то же время сахар, удаленный после ферментации, может использоваться в качестве источника углерода для роста и воспроизводства грибов, тем самым метаболизируясь, чтобы производить больше ферментов [30]. Поэтому различные микроорганизмы могут использоваться в качестве биокалистов, чтобы играть важную роль в биотрансформации природных продуктов. Ученые в стране и за рубежом использовали бактерии и грибы для проведения исследований биотрансценции женьшеня (рис. 2).
Исследования показали, что некоторые грибы и бактерии, такие как Aspergillus Нигер, Fusarium sp., Penicillium sp., Cordyceps sinensis и Armillaria mellea, Bifidobacterium breve, Bacillus sp., Lactococcus lactis и Lactobacillus plantarum sub sp., Terrabacter sp., Cellulosimicrobium cellulans sp., И Thermotoga thermarum может метаболизировать сахарные группы женьшеня C-3 или C-20 для производства редких женьшень или агликосов (таблица 3). Aspergillus Нигер может метаболизировать женьшень Rb1 и Rb3 женьшень Rd, F2 и C-K, соответственно [31, 38]; Он также может гидролизировать 3-O-Glc из ginsenosides Rb2 и Rc сначала, а затем гидролизировать 20-O-Ara для производства одного гидролиза: Rb2 → C-O → C-Y → C-K, Rc → C-Mc1 → C-Mc → C-K, и в основном через путь Rb3 → C-Mx1 → C-Mx → C-K для гидролиза 3-O-Glc из Rb3 → Rd → F2 → CK [38]. Пенициллий гидролизует женьшень и женьшень мономеры по пути Rb1 → Rd → F2 → C-K, производя редкие женьшень [32-33,52]; Фузариум преобразует женьшень общее количество сапонинов в редкую женьшень к-к через культуру ферментации [47]; Ферментум может преобразовать женьшень F2 в женьшень C-K [39]; Bacillus subtilis гидролизирует позиции C-3 и C-20 женьшеня Rb1 на позициях C-3 и C-20 aglycone, соответственно, для получения женьшенозидов Rd, Rg3[39] и Gyp-xⅦ, F2[40]. Гены глюкозидазы, клонированные из Lactococcus lactis[36] и Thermus thermophilus[42-43], были выражены в Escherichia coli для производства глюкозидасов, которые могут постепенно гидролизировать внешние и внутренние глюкозы положения C-20 и C-3 женьшеносида Rb1. Реакция выглядит следующим образом: Rb1 → Rd → Rg3 (S) и F2 → C-K.
In recent years, edible fungi have also been used in the study of the glycosidase hydrolysis of ginseng saponins. For example, Cordyceps militaris can convert ginseng saponin Rb1 to the rare ginseng saponin F2, with the conversion pathway being Rb1→Rd→F2 [44]. The honey ring fungus can convert ginsenoside Rb2 into the rare ginsenosides C-Y and C-K, with the conversion pathway being Rb2→C-Y→C-K [45]. This is the first time in the literature that a basidiomycete has been used to convert ginsenoside Rb2 into the rare ginsenoside C-K.
Микробная трансформация имеет свои уникальные преимущества. Условия реакции мягкие, и по сравнению с физико-химическими методами преобразования, это не требует высоких температур и давления, что снижает затраты. Во время реакции практически не используются органические реагенты, которые могут обеспечить активность женьшеня в наибольшей степени. Ферменты, закрытые микроорганизмами, могут разлагаться и потреблять примеси, такие как сахар и белки, увеличивать концентрацию женьшеня и увеличивать коэффициент преобразования. Метод микробного преобразования имеет высокую эффективность использования сырья и высокую эффективность преобразования, что не только экономит сырье, но и увеличивает производство [46].
2.1.2 гидролиз фермента сахарной группы женьшеня
Специфика микробного преобразования ниже, чем прямого преобразования фермента, поэтому деятельность гликозидазы должна быть скорректирована, чтобы ограничить производство побочных продуктов и улучшить специфичность преобразования.
Организация < < сапонины > >have structural differences and functional diversity. Ginseng saponin structure includes 1 to 4 glycosidic bonds. Common sugar moieties include β-glucose, L-arabinose, D-xylose and L-rhamnose, which require the synergistic action of different enzymes to achieve bioconversion. Common enzymes include glucosidase, mannosidase, arabinosidase, and xylosidase, which are mainly isolated and purified from microorganisms or animals and plants. In the study of enzymatic conversion of ginsenosides, researchers first used enzymes produced by natural microorganisms to hydrolyze the glycosidic bonds of ginsenosides. For example, using Monascus purpureus, which can produce β-glucosidase extracellularly, to ferment ginsenosides achieved a 2.3-fold increase in the mass fraction of Rg3 in ginsenosides [57]. As research progressed, researchers extracted relatively pure β-glucosidase from fungi, animals and plants to hydrolyze ginsenosides. Jin В то же время- эл. - привет.[58] used β-glucosidase to convert the ginsenosides Rb1, Rb2, Rc and Rd were converted into the rare saponin Rh2 using β-glucosidase. However, the enzymes isolated from microorganisms and animals and plants are mostly mixed enzymes, which are difficult to convert in a targeted manner and have many side reaction products, which increases the difficulty of isolating and purifying the conversion products.
С развитием молекулярной биологии и генной инженерии технологии, использование генетической рекомбинации технологии для создания генетически инженерных бактерий для проведения гликозилирования женьшеня сапонинов является эффективным способом повышения эффективности преобразования. Escherichia coli и дрожжевые клетки, как зрелые носители выражения, часто используются в качестве предпочтительных векторов выражения для рекомбинантных биологических ферментов белков. Введение гена гликозилтрансферазы в векторную клетку эффективно производит женьшень Rh2 [59]. В последние годы xylosidase ген xln-DT из термофильной бактерии был рекомбинирован в Пэт -20b plasmid ниже пелбного сигнала пептида с использованием генетической технологии сварки. Рекомбинант plasmid pelB-xln-DT был преобразован в экспрессивный носитель E. coli E. coli BL21 (DE3), а фермент использовался в качестве катализатора для гидролиза гликосидной связи notoginseng saponin R1. И успешно производится женьшень Rg1[44]. Jeon В то же время- эл. - привет.использовали рекомбинант glucosidase (MT619) для преобразования женьшень Re, и путь преобразования был Re →Rg1 →F1 →MT1[60]. MT1 является новым ППТ-тип женьшень. Генная кодировка β-glucosidase из двух штаммов Bacillus была клонирована и высоко выражена в E. coli BL21 (DE3). Использование сырой экстракта BL21 (DE3) для гидролиза женьшеня Rb1 с целью получения женьшеня F2[40]; Рекомбинантный фермент, выраженный в тандеме в E. coli, имеет более высокую чистоту и может преобразовать женьшень PPD- типа в редкий женьшень Rh2(S)[61].
В настоящее время в большинстве исследований используется Один фермент для преобразования женьшеня. Поэтому будущие исследования могут использовать технологию генетической рекомбинации для экспрессии ферментов с различными функциями в одном и Том же носителе. Благодаря синергическому эффекту различных ферментов может быть достигнута цель производства редких женьшень и их производных, которые удовлетворяют конкретные потребности, что позволит повысить коэффициент использования ресурсов женьшеня.
2.2 микробная модификация структуры агликонуса женьшеня
Исследования по структурной модификации женьшеня агликосов были в основном сосредоточены на женьшень типа PPD, и производные инструменты, такие как 25-OH-PPD и 25-OCH3-PPD были получены. Методы производной, как правило, являются химическими и физическими методами, и было проведено мало исследований по изменению структуры агликоне биологическими методами. Основными методами, о которых сообщалось, являются увлажнение двойной связи на позиции C24-C25 у крыс. Основной метаболический путь 20s-damar -24-en-2α, 3β, 12β, 20- тетрол (GP) наблюдается окисление 24, 25- двойной связи, чтобы сформировать 24, 25- эпоксид, затем гидролиз и переустройство, чтобы сформировать 20, 24- эпоксид (рис. 3) [62]. Исследователи использовали совместное выращивание женьшеня сапонины и кордичепс militaris для преобразования женьшень Rg1 в 25-OH-(S/R)- rh1 и panaxoside R1 в 25-OH-20(S/R)- r2. Содержание 25-OH производных в продуктах преобразования гораздо выше, чем женьшень Rh1 и panaxoside R2 делает его легко изолировать и очистить производных [63-64]. С использованием слизистой оболочки спиноса при совместном выращивании 20(S)- протоанаксатриола было получено шесть производных. Результаты исследования доказали, что производные женьшеня, полученные в результате дегидрогенации в положении с -12, за которой следует дальнейшая гидроксиляция в положении с -7 или с -11 и карбониляция в положении с -15, а также двойная переустановка облигаций в положении с -26, имеют значительную ингибиторную активность в отношении раковых клеток [65].
Согласно национальным и зарубежным исследованиям, предполагается, что эта система может быть наиболее эффективной с точки зрения региональной селективной гидроксилирования женьшеня. Экспериментальные исследования показали, что эти производные оказывают различное воздействие in vivo и in vitro через различные механизмы, и их биологическая активность выше, чем у обычного женьшеня [66]. Например, Rb1 проходит дегидрогенную реакцию на формирование дигидроженьшеносида гд -Rb1, который может восстанавливать поврежденные нейроны, не влияя на системные параметры, а эффективная доза гд -Rb1 в 10 раз ниже, чем у Rb1 [67]. Производное октилового эфира Rh2- o из Rh2 женьшеносида имеет более высокую активность по сравнению с Rh2, активируя внутреннюю траекторию апоптоза [68]. Ацетиловые производные PPD имеют значительную антипролиферативную и аппетитную индукционную активность, а некоторые производные имеют более высокую активность по сравнению с PPD [69]. Для повышения антиопухолевой активности в 25- ой PPD было введено пиразиновое кольцо. 2- пиразин -PPD может существенно препятствовать распространению раковых клеток желудка и мало токсичен для нормальных клеток (эпителиальная линия клеток желудка GES-1 человека) [70]. Производная 25-OH-PPD от aglycone PPD имеет лучшую антиканцеровую активность, чем существующие лекарства на рынке, такие как женьшень Rg3, paclitaxel и аминолевулиновая кислота [71].
Таким образом, сохраняя первоначальную активную структуру женьшеня, структура aglycone женьшеня может быть изменена путем введения полярных групп и фармакофорных групп для повышения растворимости в воде, адресности и эффективности женьшеня, а также улучшения биодоступности женьшеня.
2.3 гликозиляция женьшеня
Начиная с 2,3- окислителя кваленаБиосинтез женьшеняМожет быть разделен на три этапа: 2,3- оксидоскаленовый циклон (OSC) циклические 2,3- оксидоскаленовый; Гидроксиляция и гликозилационные реакции затем осуществляются цитохромом (Cyt) и гликозилтрансферазы (GT), в конечном итоге производя женьшень [72]. UGT фермент является одним из наиболее критических ферментов в синтезе редких женьшень в живых организмах [73], а также последним шагом в биосинтезе женьшень. Ген UGT был клонирован из Lactobacillus rhamnosus и выражен в E. coli BL21 (DE3). Рекомбинантный углеродный белок может преобразовать Rh2 в две новые женьшень, глюкозилированный женьшень Rh2 и диглюкозилированный женьшень Rh2 [74].
Тритерпеноид агликон катализируется UGT, чтобы сформировать женьшень с различными структурами. Протопанаксадиол-агликон гликозилируется на позициях с -3 и с -20, а протопанаксадиол-агликон-на позициях с -6 и с -20 [80]. На рис. 4 показана редкая форма глюкозиляции женьшеня. Гликозилтрансферазе 73C5 (UGT 73C5) был изолирован от арабидопса талиана и постепенно добавлен в PPD. Эта гликозилтрансферазы может выборочно передавать глюкозу в гидроксиловую группу PPD C-3 для синтеза женьшеня Rh2, достигая наибольшего объема сообщаемой урожайности женьшеня Rh2 (3,2 мг/мл) [75]. Глюкозилтрансферазы 74AE2 (UGT 74AE2) ускоряют передачу глюкозы гидроксилным группам PPD C-3 и C-K в состав Rh2 и F2, соответственно [76]. Гликозилтрансферазы 94Q2 (UGT 94Q2) могут передавать глюкозу в Rh2 и F2 для формирования Rg3 и Rd, соответственно [77]. UGT51 является одним из гликозилтрансферазов в Saccharomyces cerevisiae S288c [78], который может передавать глюкозу в гидроксиловую группу C-3 PPD для формирования Rh2 [79]. Будущие исследования по угу могут позволить получить представление о механизме регулирования глюкозиляции женьшеня и предложить новые пути изменения производства женьшеня.
В качестве прямого фактора, катализирующего образование женьшеня, уги играют жизненно важную роль в производстве женьшеня путем биокатализа. Большинство производных от растений уггов имеют низкую каталитическую активность, в то время как рекомбинантные микробные угги обладают особыми биокатализирующими свойствами, такими как субординированность и высокие уровни экспрессии в клетках микробных субстратов, что делает их эффективными инструментами для производства женьшеня. Поэтому необходимо повысить каталитическую активность UGTs для увеличения урожайности и производства целевых редких женьшень.
3. Заключение и перспективы
Studies have shown that rare ginsenosides have higher medicinal value- да. В то же время низкая растворимость в воде и низкое содержание редких женьшень ограничивают их применение. Гидролиз или гликозилация женьшеня внутриклеточными или внеклеточными ферментами различных микроорганизмов эффективно преобразует полисахакрид женьшеня и неактивные агликосы в редкие женьшень, тем самым повышая биодоступность женьшеня.
Исследования показали, что изменения в некоторых функциональных группах могут изменить молекулярную структуру и свойства, тем самым влияя на привязку лекарств к рецепторам и влияя на эффективность. Например, алкильные группы могут повысить растворимость липидов в соединении, уменьшить разобщенность, повысить стабильность и продлить срок действия препарата; Сульфгидриловые группы повышают растворимость липидов и облегчают усвоение лекарственных средств; Амидные связи могут легко образовывать водородные связи с биологическими макромолекулами и связывать их с рецепторами, проявляя особую структурную специфику; А разрыв гидроксиловой группы для формирования водородной связи повышает растворимость соединения в воде, тем самым повышая активность препарата.

Исходя из структуры женьшеня, предполагается, что гидроксилационные реакции могут происходить на позициях C-2, C-11, C-15, C-24 и C-30; Двухвалютные углеродные облигации на позициях с -12 и с -13 могут подвергаться дополнительным реакциям и окислительным реакциям; В то же время женьшень диола-типа может быть окислена на C-12 и C-24 позиции, чтобы сформировать женьшень оритола-типа. Поэтому, если ферменты, которые могут изменить структуру женьшеня могут быть найдены путем скрининга различных микроорганизмов и ферментов, и некоторые группы могут быть добавлены или нокаут на основе существующей активной структуры редких женьшеня, фармакологической активности и таргетизации женьшеня женьшеня может быть улучшена, и биодоступность женьшеня женьшеня может быть увеличена, обеспечивая новое направление для структурной модификации женьшеня.
At the same time, with the continuous development of technology in the fields of food, medicine, the continuous development of technology in the fields of food, medicine, and biochemistry, researchers can use genetics, molecular cytology, and other interdisciplinary integration, as well as high-throughput screening and genomics technology to select or design enzymes or strains with high selectivity and conversion rates. Biological means can be used to achieve the industrial Производство и продажаof highly active rare ginseng saponins and their derivatives, further increasing the yield of rare ginseng saponins and their highly active derivatives. This is of great significance for making full use of ginseng resources for the benefit of the public.
Ссылка:
[1] Чжин хи ким, мисон ким, сон ми юн и др. Женьшень Rh2 вызывает апоптоз и подавляет эпителиально-мезенхимальный переход в клетках гек1a и ишикава эндометрический Рак [J]. Биомедицина и Фармакотерапия,2017,96. 871-876.
[2] Цзян з, ян и, ян и др. Женьшень Rg3 ослабляет устойчивость к цисплатину при раке легких путем понижения уровня пd-l1 и восстановления иммунитета [J]. - на биометре. Фарм. 2017.96.378 — 383.
[3] Яо (фр.) Ч, ч, ч. - добрый вечер. - Y. Ginsenosides in Рак: Рак: A/данные отсутствуют. В центре внимания on the Правила и положения of 1. Ячейка Обмен веществ. Обмен веществ. Биомед (биомед) - в аптеке. 2022 10 октября;156:113756. Doi: 10.1016/j.biopha.2022.113756.
[4] Ю х, ван и др. Преобразование женьшеня Rb1 в шесть видов высокобиоактивного женьшеня Rg3 и его производных с помощью катализаторов FeCl3. Чем фарм булл (токио). 2018 год;66(9):901-906.
[5] Чжан дж., Ай-зи, ху и др. Значительное влияние промышленной стерилизации на преобразование женьшеня в свежую женьшень целлюлозы на основе широко целевого анализа метаболических веществ. Food Chem X. 2022 Август 9;15:100415.
[6] Хасегава, хидео, сон и др. Основные метаболиты женьшеня сапонина образуются кишечными бактериями. Планта медика, 1998, 62(5), 453-457.
[7] Хасегава, хидео, Сон и др. Роль кишечника человека Prevotella oris в гидролиза женьшеня - сапонины. Планта медика, 1997,63(5), 436 — 440.
[8] шангуань - лихуа, Лю (LIU) - гокуан. Прогресс в исследовании метаболизма женьшеня компонентов [J]. Китайские традиционные и травяные препараты, 1999 год (11):865-870.
[9] В чем дело? Бён хун, - ли, Сан чжун хи и др. In vitro антигенотоксическая активность романа Метаболиты женьшеня сапонина образуются кишечными бактериями. Planta Medica, 1998, 64(6), 500 -503.
[10] иошимаса - ямагути, Организация < < масайя > > - хигаши, - хидеши - кобаяши. Последствия для окружающей среды of ginsenosides on Недостатки в работе Результаты деятельности компании В результате чего Быскополамин у крыс [J]. Европейский журнал фармакологии, 1996, 312(2): 149-151.
[11] Kim WY, Kim JM, Han SB и др. Паром женьшеня при высокой температуре повышает биологическую активность [J]. J Nat Prod, 2000, 63(12):1702-1704.
[12] го хи, син у, Сан юк и др. Производные женьшеня синтезированы из 20(R)-panaxotriol: синтез, характеристика и антиопухолевая деятельность, направленная на пути HIF-1. J резолюция 2022 года женьшеня;46(6):738-749.
[13] ким го, ким н, сон ги и др. Ингибитивная деятельность редкого женьшеня Rg4 на чекальной перевязке и пунктуальном сепсе. IntJ Mol Sci. 2022 16; 23(18):10836. Doi: 10.3390/ijms231810836.
[14] Chen Z, 13. ВанG, Xie X и др. Женьшень Rg5 аллостерически взаимодействует с P2RY12 и улучшает глубокий тромбоз вен, противодействуя нейтрофилу нетозу и воспалительной реакции. Передняя иммунизация. 2022 Август 12;13:918476.
[15] лю - янан. Подготовка женьшеня Rg5 и его антижелудочной активности и активности рака молочной железы [D]. Шэньси: северо-западный университет, 2019.
[16] DENG J - джей,LIU Y, DUAN Z G, В то же время- эл. - привет.Протопанаксадиол и протопанаксатриол типа сапонинов улучшают глюкозу и липидный метаболизм сахарного диабета 2 типа у мышей с высоким содержанием жира/мышей, вызванных стрептозоцином [J]. Передняя аптека,2017, 8: 506.
[17] MAENG Y S, MAHARJAN S, KIM J H, et - эл. - привет.Rk1, женьшень, является новым блокирующим сосудистой утечки, действующим через актин структурной перестройки [J], PLoС. SOne, 2013, 8(7) : e68659.
[18] рю н, рахман м а, хван х и др. Женьшень Rk1 является новым ингибитором NMDA рецепторов в культуризированных нейронах крыс гиппокампов [J]. J женьшень Res, 2020, 44 (3) :490-495.
[19] о джей м, ли джей, им в и др. Женьшень Rk1 вызывает апоптоз в нейробластомных клетках за счет потери митохондриального мембранного потенциала и активации каспазов [J]. Int J Mol Sci, 2019, 20(5) : 1213.
[20] SIDDIQI M H, SIDDIQI M Z, AHN S, и др. Phytother Res, 2014, 28(10) : 1447 — 1455.
[21] кришика самбял, рахул викрам сингх. Производственные аспекты тестостерона путем биотрансформации микробов и перспективы на будущее [J]. Стероиды, 2020, 159(C).
[22]NAN bo,YOU ying,WANG yushan, et al.Research Progress on Microbial B. преобразование системыof женьшень [J]. Исследования и разработки в пищевой промышленности, 2017, 38(14): 196 — 199
[23] чжоу чжун лю, ли чунь ян, чэнь лин-хао1 и др. Биотрансформация природных ресурсов Сапонины [J]. Китайский журнал экспериментальных традиционных медицинских формул, 2019, 25(16): 173-192.
[24] м.дж., ын-а бэ, мин гён и др. Метаболизм 20(S)- и 20(R)- женьшень Rg3 кишечных бактерий человека и его отношение к in Vitro биологической деятельности [J]. - биол. - да. Фарм булл, 2002, 25(1): 58 — 63.
[25] В чем дело? - минксин, 1. Ли - фантонг, Чжан (Китай) - ян, et - эл. - привет. Biotransformation of Rare Протопанаксадиол. - да Организация < < сапонинби > > По правам человека Кишечная микрофлора [J]. Химический журнал китайских университетов, 2019, 40(07): 1390-1396.
[26] чжан янь, ли фангун, хан минксин и др. анализ метаболитов протоанаксатриола сапонинов в кишечной флоре человека с помощью RRWC-q-tof MS и UPLC-QQQ MS[J]. Журнал китайского общества масс-спектрометрии, 2020, 41(01): 66-75.
[27] TANG lan1, FU lulu, SHEN liting, et al.of total saponins Организация < < панакс > >notoginseng by кишечная флора крыс in vitro[J]. Китайские традиционные и травяные препараты, 2018, 49(02): 396-399.
[28] го и п., чэнь м., Шао л и др. Количественная оценка метаболитов Panax notoginseng saponins в крысиной плазме с микробиотрансформацией через кишечника с помощью HPLC-MS/MS[J]. Китайский журнал натуральных лекарственных средств, 2019, 17(3): 231-240.
[29] чэнь сицзянь, у дунсюэ, лю суин и др. Достижения в химической и биологической трансформации женьшеня [J] китайская традиционная патентная медицина,2022, 44(5): 1539-1545.
[30] ван шаньшань, ху пин, ю шаоуэн. Прогресс в исследованиях биотрансформации природных продуктов [J]. Китайский журнал новых лекарств, 2016, 25(1): 71-75.
[31] гао хуан, чжоу аньдун, юань е и др. Ферментативное разложение женьшенозида Rb1 для подготовки соединения K Aspergillus Нигер sp. J7[J]. Современная биотехнология, 2016, 6(02): 98-104.
[32] песня X L, Wu H, Piao X C, et al. Микробное преобразование женьшеня, извлечённое из авантвентных корней женьшеня Panax [J]. Электронный журнал биотехнологии, 2017, 26:20 — 26.
[33] Янь-кью, чжоу-ю, ши-х-л и др. Пути биотрансформации женьшеносида Rb1 в соединение K by β-glucosidases in fungus Paecilomyces Bainier sp. 229[J], биохимия процессов, 2010, 45(9): 1550-1556.
[34] Hu Y B, Wang N, Yan X C, et al. Воздействие женьшеня на продукты биохимической обработки женьшеня Rb1 со стороны Cellulosimicrobium cellulans sp. 21 и его механизмов [J], биохимия процессов, 2019, 77: 57-62.
[35] джитендра упадхайя, мин чжи ким, ё н хой ким и др. Ферментативное образование компада-к из женьшеня Rb1 путем подготовки фермента из культурной мицелии Armillaria mellea[J]. Журнал женьшеня исследования, 2016, 40(2): 105-112.
[36] ли линг, ли Су чжин, юань цю пин и др Al. Производство биоактивных веществ Женьшень Rg3(S) и соединение K с использованием рекомбинанта Lactococcus lactis[J]. Журнал женьшеня исследования, 2017, 42(4): 412-418.
[37] хёджин ли, сын иль ан, бён ук ян и др. Биохимическое преобразование женьшеня молочных кислотных бактерий на основе яичжан в горной женьшень [J]. Письма по микробиологии и биотехнологии, 2019, 47(2): 201-210.
[38] лю СИ, зуо к з, ю х с и др. Подготовка незначительного женьшеня к-mx и к-k из женьшеня листьев нотоженьшеня специальным типом женьшеносидазы i [J]. Биохимия процессов, 2015, 50(12): 2148 -2167.
[39] чжан р, хуан х м, ян х дж и др. Крайне селективное производство соединения K из женьшеносида Rd путем гидролиза глюкозы при использовании гликозида с -3 Грава-глюкозидаза бифидобактерии breve ATCC 15700[J]. Журнал микробиологии и биотехнологии, 2019, 29(3): 410-418.
[40] альмандо - джеральди, Ни (ни) Матузахрохабет, - фатимахаб, al. 1. Ферментативная ферма biotransformation of ginsenoside Rb1 by Рекомбинантная гравитация-глюкозидаза бактериальных изолятов от индонезии [J]. Биокатализ и сельскохозяйственная биотехнология. 2020, 23(C): 101449 — 101449.
[41] Li L, Lee S J,Yuan Q P и др. Производство биоактивного женьшеня Rg3(S) И соединение K с использованием рекомбинантного лактококка lactis[J]. Журнал женьшеня исследования, 2017, 42(4): 412-418.
[42] Pei J J, Xie J C, Yin R, et al. Ферментативная трансформация женьшеня Rb1 в женьшень 20(S)-Rg3 на GH3 Граво-глюкозидаза из термогатермарума DSM 5069 T[J]. Журнал молекулярных катализаторов B: энзиматика, 2015, 113:104 — 109.
[43] чжан с н, се дж., чжао л. Г. клонирование, чрезмерная компрессия и определение термостабильности Дозидазе из термотоги Petrophila и сотрудничал преобразования женьшень экстракт женьшень 20(S)-Rg3 с а β-glucosidase[J]. Биохимия, 2019, 85:159-167.
[44]114 — 120. [LI] Qi, qi, - до свидания. - синььи, В настоящее время - юдзи, et al. Строительство зданий и сооружений of В целом по стране cell 3. Катализатор Таз-XLN-dt and its 3. Применение В биотрансформации Panax notoginsenoside R1[J]. Журнал лесного хозяйства, 2020, 5(04): 114 — 120.
[45] мин чжи ким, джитендра упадда я я, мин суюн и др. Высокорегионелективная биотвация женьшеносида Rb2 в соединение Y и соединение K by β-glycosidase очищен от Armillaria mellea mycelia[J]. Журнал женьшеня исследования. 2017, 42(4) : 504-511.
[46] чжун йетинг. Обследование женьшеня Организация < < сапонин > > В. преобразование системы - штамм Тмпси - 3 and В его рамках Transformation В общей сложности Saponins of Panax Quinquefolium [D]. Шанхай: шанхайский обычный университет, 2012.
[47] ян юаньчао, ван юньпин, ян мейша и др. Обследование патогенных грибов растений путем производства женьшенозидного соединения K [J]. China Journal of Chinese Materia Medica, 2011, 36(12): 1596-1598.
[48] чэнь ян, чжан ммайпин, ван и и др. Женьшень, преобразованный в микроб Rg3 от общего количества сапонинов женьшеня Panax Bacillus subtilis [J]. Lishizhen Medicine and Materia Medica Research, 2014, 25(11):2676 — 2678.
[49] Цзинь янь, цзинь сянмэй, инь чэнгрибио-трансформация основной женьшень Re в незначительные женьшень Rh1by Sphingomonas sp.2- f2 [J]. Сельскохозяйственный научный журнал янбянского университета, 2011, 33(02): 103 — 107.
[50] лян чжици, чжан цзинлу, цзин хайчжу и др. Микробиологическое преобразование женьшеня Rg3 в Rh2[J]. Женьшень исследования, 2018, 30(03): 6-10.
[51] янь-кью, чжоу-ю, ши-х-л и др. Пути биотрансформации женьшеносида Rb1 в соединение K by Грау-глюкосидазы в грибках Paecilomyces Bainier sp. 229[J]. Биохимия процессов, 2010, 45(9): 1550 — 1556.
[52] Ye L, Zhou C Q, Zhou W, et al. Биохимическое преобразование женьшеня Rb1 в женьшень Rd с помощью высокоустойчивых к субstrate Paecilomyces bainier 229-7[J]. Технология биоресурсов, 2010, 101(20):7872-7876
[53] чэнь сяочунь, дай чжу, фу жунцжао. Биокаталитический синтез редкого женьшеня Rh2[J]. Химическая промышленность цзянси, 2019(02): 55 — 57.
[54] Su J H, Xu J H, Lu W Y и др. Ферментативная трансформация женьшеня Rg3 в Rh2 с использованием недавно выделенного Fusarium atum ECU2042[J]. Журнал молекулярных катализаторов B Enzymatic, 2006, 38(2):113 — 118.
[55] Su J H, Xu J H, Yu H L и др. 1. Свойства романа β-glucosidasefrom Fusarium пролифератум ECU2042, который преобразует женьшень Rg3 в Rh2[J]. Журнал молекулярных катализаторов B Enzymatic, 2009, 57(1-4):278-283.
[56] у Сюли, ван ян, чжао вэньцянь и др. Грибковая биотрансформация женьшеня Rg3[J]. Acta Microbiologica Sinica, 2008(09): 1181-1185.
[57] конг юйи, сунь цзя, ю ен и др. Исследование о преобразовании женьшеня Rg3 ферментирован монаскус пурпуреус [J]. Китайские традиционные и травяные препараты, 2018,49(06): 1298-1303.
[58] джин ф. Х. На втором международном симпозиуме по естественной медицине и микрофлоре [м]. Токио, Япония 1998, 24-26:1-15 октября.
[59] Zhuang Y, Yang G Y, Chen X H, et al. Биосинтез производного женьшеня Rh2 растений в дрожжах путем изменения назначения ключевого неразборчивого микробного фермента [J]. Метаболическая инженерия, 2017, 42:25 — 32.
[60] бён мин чон, чон ин бэк, мин сон ким и др. Характеристика нового женьшеня MT1 производится ферментативной трансхамнозиляции женьшеня протоанаксатриола типа Re[J]. Биомолекул. 2020, 10(4): 525 — 525.
[61] мухаммад зубайр сиддики, иполито амарал шименес, бон гю сон и др. Увеличение производства женьшеня Rh2(S) из основных женьшень PPD- типа с использованием BglSk клонирован из Saccharibacillus kuerlensis вместе с двумя гликозидазами серии [J]. Саудовский журнал биологических наук. 2021, 04, 079.
[62] Chen H, Dong, Zhi F и др. Открытие, синтез и структурно-активные отношения 20- s-damar -24-en-2 α, 3 β, 12β,20-tetrol (GP) производных инструментов в качестве нового класса AMPK α2β1 γ 1 activators[J]. Биоорганическая и Лекарственная химия, 2016, 24(12): 2688 — 96.
[63] синь с, юй х а, юй х и др. Высокорегиослективная биотрансформация женьшеня Rg1 до 25-OH производных 20(S/R) rh1 Cordyceps sinensis-science-direct [J]. Биоорганическая и 2020, 30(21): 127 — 504.
[64] лю дж., ю х н., цю з д., и др. кордицепс синенсионных сред биотрансформации notoginsenoside R1 в 25- ом -20(S/R)-R2 с повышенным кардиохирургическим эффектом от доксиндуцированной клеточной травмы [J]. Достижения РСК, 2022, 12, 129-38.
[65] Chen G T, Ge H J, Song Y, et al. Биотрансформация 20(S)- протоанаксатриола слизистой раковиной и антираковая деятельность некоторых продуктов [J]. Биотехнологические письма, 2015, 37(10): 2005 — 2009.
[66] ким м Y, чо дж. 20 - s-дигидропротопанаксадиол, производный женьшеня, повышает врожденную иммунную реакцию моноцитов и макрофагов [J]. Журнал женьшеня Research, 2013, июл, 37(3): 293-9.
[67] аканака м, жу п, бо з и др. Внутривенное вливание дигидроженьшенозида Rb1 предотвращает сжатие спинного мозга и ишемическую травму мозга через упрегуляцию вегф и Bcl-XL.[J]. J нейротравма, 2007, 24(6): 1037 — 1054.
[68] Chen F, Zheng S L, Hu J N,et al. Октиловый эфир Rh2 женьшеня вызывает апоптоз и остановку клеточного цикла G1 в клетках человека hepg2cell, активируя экстраинсивный апоптотический путь и модулируя сигнальный путь Akt/p38 MAPK [J]. Журнал сельскохозяйственной и пищевой химии, 2016, acs.jafc. , 6b03519.
[69] Du G J, Dai Q, Williams S и др. Синтез производных протопанакадиола и оценка их деятельности по борьбе с коррупцией [J]. Антиканцеровые препараты, 2011, 22(1):35.
[70] Xu D, Tao L, Yan L, et al. 2-Pyrazine-PPD, новая производная dammarane, продемонстрировали антиканцерогенную активность посредством реактивного кислородного специального апоптоза и эндоплазменного ретикулярного стресса в клетках рака желудка [J]. Европейский журнал фармакологии, 2020, 881.
[71] Xu D, Yuan Y, Fan Z, et al. 4-XL-PPD, новая производная женьшеня, как потенциальные терапевтические средства для рака желудочной железы, показывает антиканцерогенную активность через индуцирование клеточного apoptosis медикаментозное образование реактивных видов кислорода и ингибирование мигрирующих и инвазивных [J]. Биомедицина и Фармакотерапия, 2019, (118): 108.
[72] Li Y, Baldauf S, Lim E K, et al. Фитогенетический анализ мультигенного семейства UDP-гликозилтрансферазыArabidopsis thaliana[J]. Журнал биологической химии, 2001, 276(6):4338.
[73] кристенсен л п. Женьшень: химия, биосинтез, анализ и потенциальные последствия для здоровья (глава 1)[J]. Adv Food Nutr Res, 2008, 55(55):1-99.
[74] ван D D, Ё н чжу - ким, 3. ДНП Пэк! Пэк! Пэк! et al. Гликозилтрансформация женьшеня Rh2 into - два раза. Роман о любви ginsenosides Использование рекомбинатной гликозилтрансферазе из Lactobacillus rhamnosus и ее применения in vitro [J]. Журнал женьшень исследования. 2021 45(1): 48-57.
[75] Hu Y, Xue J, Min J, et al. Биокаталитический синтез женьшенового Rh2 с использованием арабидопса thaliana глюкозилтрансферизируемой комбинированной реакции [J]. Журнал биотехнологии, 2020, 309: 107 — 112.
[76] Jung S C, Kim W, Park S C, et al. Два женьшеня UDP-glycosyltransferases синтезируют женьшень Rg3 и Rd.[J]. Предприятия и предприятия Клеточная физиология, 2014, 55(12): 2177 — 88.
[77] хоролрагча, альтанзул, ким, et al. Группировка по группам and 3. Определение характеристик По крайней мере, glycosyltransferase Гены и гены from Panax Женьшень мейер [J]. Джин, 536(1): 186-192.
[78] Warnecke D, Erdmann R, Fahl A и др. Клонирование и функциональное выражение глюкоцилтрансферазов UGT, кодирующих стерол глюкоцилтрансферазы из Saccharomyces cerevisiae, Candida albicans, Pichiapastorisand dicyostelium discoideum[J]. J Biol Chem, 1999, 274(19): 13048-13059. [79] Zhuang Y, Yang G Y, Chen X H, et al. Биосинтез сортового ребра женьшеня Rh2 в дрожжах путем изменения назначения ключевого неразборчивого микробного фермента [J]. М. : метаб инг., 2017, 42: 25 — 32.
[80] чжао J N, Wang — р ф., Чжао чжао чжао S J, et al. 1. Аванс in Гликосинтрансферазы, the important 1. Биопарты for production of Различные женьшень [J]. Китайский журнал натуральных лекарственных средств, 2020, 18(9): 643-658.
-
Предыдущий
Natural Black Rice Extract Anthocyanins: Antioxidant Product Solutions
-
Следующий проект
Исследование редкого женьшеня Rg1 Rb1 Rg3


 Английский язык
Английский язык Французский язык
Французский язык На испанском языке
На испанском языке Русский язык
Русский язык Корейская народно-демократическая республика
Корейская народно-демократическая республика На японском языке
На японском языке




