Из чего сделан ванилин?
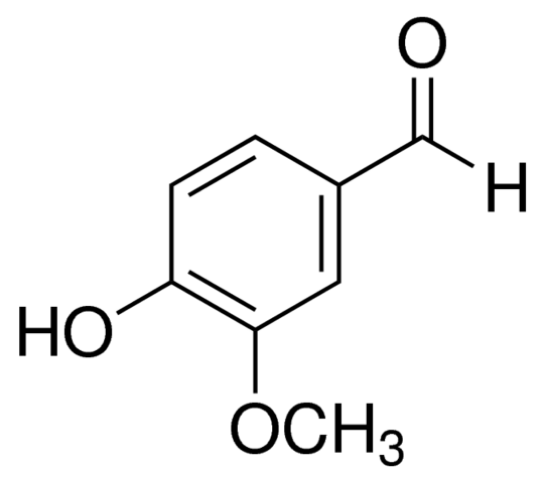
Ванилинтакже известен как ванилин, ванилин и т.д., химическое название 3- метоксия 4- гидроксибензальдегид, относительная молекулярная масса 152.15, от белой до слегка желтой иглы или порошковых кристаллов. 15, от белого до слегка желтого иглы, как или порошкообразных кристаллов. Ванилин широко распространен в природе в виде свободной формы и глюкозида, а его массовое содержание в капсулах ванили планифолии составляет 1,5% ~3% [1]. Массовое содержание ванилина в ванильных капсулах составляет 1,53% [1]. Чистый ванилин имеет сильный молочный аромат и никакого запаха. В качестве ароматической добавки, он пользуется своим небольшим количеством добавления и уникальный аромат. Широко используется в качестве лечебного, ароматизирующего агента, используется в косметике, мыла, сигареты, выпечка, кондитерские изделия, напитки и хлебобулочные изделия и другие отрасли промышленности в производстве мира ' крупнейшее производство синтетических ароматов с ежегодным объемом производства около 10 000 тонн [2].
- ваниллин. is also an important raw material and intermediate in the pharmaceutical industry, from which 3,4,5-trimethoxybenzaldehyde (TMB) can be synthesized [3], and TMB is an important intermediate in the synthesis of sulfonamide potentiator methoxybenzylaminopyrimidine (TMP), cough and expectorant asthma and antiepileptic 3,4,5-trimethoxycinnamoyl isopropylamine, etc. It is also an important intermediate in the synthesis of biphenyl dibenzoate, lisinopril, piperazole and other drugs [4]. Vanillin is an important intermediate in the synthesis of biphenyl dibenzoate, lisdexamfetamine, piperazole and other drugs [4]. Vanillin can also be used as electroplating polish, plant growth promoter, ripening agent, etc., has become a variety of uses of organic compounds, and its demand increased by 10% per year [5].
Из-за ограниченности природных ресурсов более невозможно удовлетворить растущий спрос на ванилин путем его извлечения только из растений. С тех пор как тиманн и харман определили молекулярную структуру ванилина в 1874 году, с развитием производства и углубленных исследований, диверсификацией синтетического сырья, чтобы обеспечить условия для приготовления ванилина, есть четыре производственных маршрута с большей экономической ценностью [6].
1 технологический маршрут для производства ванилина
1. Работа. 1 евгенол как сырье
В настоящее времяsynthesis of vanillin by this method was started by Reimer and Tiemann at the end of the 19th century and has been continuously improved. There are currently three process routes for this method.
Во-первых, изомеризация эугенола (из клевового масла) в присутствии щелочи преобразует аллиловую группу в молекулу эугенола в пропенеловую группу, в результате чего изоэугенол натрия, который затем окисляется окисляющим веществом, в натриевую соль ванилина, которая затем окисляется для получения ванилина. Изомеризация может осуществляться методом высокой температуры с концентрированным щелочным слоем, а условия окисления включают защиту гидроксиловой группы и прямое окисление.
Вторым является косвенное окисление, изомеризация эугенола для производства изоэугенола натрия и (CH3 CO)2 - O действия, изоэугенола ацетата, после окисления в кислотных средах, гидролизованных до ванилина [7].
В-третьих, после изомеризации эугенола до изоэугенола натрия ванилин производился электролизом в диафрагмовом электролизе с использованием промежуточных элементов редокса Mn3+/Mn2+, анода PBO2 (на основе ph2) и Ni в качестве анода при силе тока 15A/ dм2 и температуре 50-60 градусов при средней мощности 50% [8]. Аромат ванилина, получаемый с помощью этого метода, является чистым, однако его стоимость более чем в 20 раз превышает стоимость метода лигнина, который использовался в нидерландах и соединенном королевстве.
1.2 на основе сафрола
В 1927 году Япония такасаго синтезировала ванилин путем озонирования сафрола, и после постоянного совершенствования были сформированы три технологических маршрута. Во-первых, сафрол (из камфорного масла) был обработан щелочным слоем, преобразован в изосафорил путем двухцепной миграции, окислен в пиперональ, взаимодействовал с пcl5 для получения протокатехического альдегида, а затем метилирован (CH3)2 SO4 для получения смеси ванилина и изованиллина. Во-вторых, изомеризированная смесь открытия колес окисляется путем нагрева с помощью ароматического нитробензола (нитробензола) в щелочном растворе. 4- ой изомеры в смеси не реагируют и могут быть разделены.
Первая была разложена разбавленной кислотой для получения протокатехуальдегида, а вторая была метилирована и обработана разбавленной кислотой для восстановления изоэгенола. В-третьих, перечный алдегид, получаемый окисляющим изосафолем, растворяется в нитробензоле, а затем добавляется с алюминиевым боридом или алюминиевым триоксидом для окисления протокатехического алдегида при температуре 0~20 граваций, урожайность достигает 83%, а затем метилируется для получения ванилина. Этот метод был использован для производства ванилина в японии, продукт имеет хороший аромат, но изованиллин в боковой реакции трудно удалить, и стоимость более чем в 10 раз выше, чем метод лигнина.
1.3 лигносульфонаты в качестве сырья
В 1938 году компания salvo начала свою деятельность в СШАИспользуйте лигнин для производства ванилинаПри использовании серфитной целлюлозы целлюлозно-бумажной фабрики при сливе отходов сульфитного приготовления пищи, около 50% (до твердых веществ) для лигносульфоната, лигносульфоната в качестве сырья для подготовки уравнения реакции ванилина является следующим:
С тех пор как к. фройденберг впервые предложил производить ванилин путем щелочного нитробензола путем окисления лигнина, несколько заводов было построено в канаде, США и бывшем советском союзе. С тех пор как к. фройденберг впервые предложил производить ванилин путем алкалининитробензола путем окисления лигнина, в канаде, США и бывшем советском союзе было построено несколько заводов по производству ванилина из потоков сульфитовых целлюлозных отходов, которые имеют самую низкую стоимость сырья и урожайность ванилина, как правило, составляет около 15%. Производственный процесс включает концентрацию, нейтрализацию, окисление, подкисление, извлечение и переработку и т.д. Щелочно-нитробензол окисление было изменено на воздушно-катализируемое окисление. Что касается концентрации жидкого сырья, то изучается также новый процесс ультра-фильтрационной технологии для замены метода нагрева, а для последующей обработки процесса извлечения ванилина из окисляемой жидкости существуют передовые процессы, такие как щелочная экстракция, ионно-обменная экстракция и добыча диоксида углерода для замены обратного метода кислотной экстракции [9]. В настоящее время большинство отечественных предприятий следуют по маршруту гуаяколь, а некоторые бумажные заводы используют маршрут линьин для обработки бумажных отходов. Качество продукции этого маршрута низкое, и производимое ванилин содержит большое количество тяжелых металлов, которые не могут быть использованы в пищевой и фармацевтической промышленности, и большинство из них было прекращено.
1 4 гуаяколь в качестве сырья
Этот метод используется в зарубежных странах более 90 лет, а также в китае для производства ванилина в больших количествах. Гуайаколь конденсируется с р-нитросо N, н-диметиланилин гидрохлорид, формальдегид или гексаметилентететрамин в качестве сырья для подготовки ванилина. Преимущества данного метода: ванильный спирт, получаемый в результате боковой реакции, взаимодействует с п-гидроксидной аминовой группой N, N- диметиланилиновым гидрохлоридом для формирования цифуроксила, а после разложения, алкоголь, участвующий в реакции, может быть преобразован в ванилин, поэтому общая урожайность выше, около 60% (по гуанаколу). Процесс реакции гуаяколя с формальдегидом является основным процессом производства ванилина в китае.
Этот метод не опирается на какое-либо природное сырье и является полностью синтетическим методом. Хотя общая урожайность этого метода повысилась (около 60% от общей урожайности), весь процесс является более сложным, выбросы трех отходов являются значительными, а стоимость более чем в 6 раз превышает стоимость лигнина. Процесс гуаяколь-формальдегида используется в китае на протяжении десятилетий, и он по-прежнему является основным маршрутом производства ванилина в китае. Этот процесс использует 4- нитросо-н, n-диметиланилин в качестве окисляющего агента, а побочный продукт реакции 4- амино-н, n-диметиланилин, труднее поддается загрязнению и имеет много этапов переработки, поэтому в зарубежных развитых странах этот процесс был заменен новым методом гуайаколь в начале 80 - х годов [10]. В этом методе гуаяколь конденсируется с помощью гликсалиновой кислоты в щелочном состоянии, а раствор конденсационной реакции восстанавливает гуаяколь, а затем окисляется с помощью каталитического окисления медной соли, которое окисляет конденсационный продукт, замещающий фенилгликолическую кислоту (замещающую манделическую кислоту) в соответствующую кетовую кислоту. Продукт конденсации окисляется до соответствующей кетовой кислоты путем декарбоксиляции.
Выход промышленного производства этого метода может достигать 70%, и этот метод и метод лигнина являются основными методами производства ванилина в зарубежных странах. Однако внутренний производственный потенциал этого метода еще не сформирован. Начиная с середины 80 - х, некоторые подразделения в тяньцзине, ляонине, цзянсу и пекине разработали этот процесс и провели пилотные испытания, а урожайность ванилина достигла 48% ~ 60%, но она не могла быть индустриализована по техническим причинам [11]. В настоящее время иностранные производители с большим производственным потенциалом ваниллина включают бумажные заводы онтарио, Канада, "монсанто кемикэл компани", Соединенные Штаты, "рон-пуленк", Франция, и норвежскую компанию "боле геде". Основными производственными предприятиями ванилина в китае являются компания Jilin Chemical Industry Company и шанхайский ароматический завод, в котором производимый JICC бренд White Bear vanillin пользуется высокой репутацией на международном рынке.
2 ход синтеза ваниллина
Синтетические ароматы, которые в настоящее время доминируют в индустрии вкусов, не зависят от естественных условий, имеют стабильное качество, могут быть произведены в больших или малых масштабах, и гораздо дешевле, чем их естественные аналоги. С ростом спроса на специи (продажи специй выросли примерно в 10 раз за последние 20 лет и, по прогнозам, в будущем увеличатся на 8,2% в год), спрос на синтетические специи растет. 2% в год в будущем, разработка и использование новых синтетических ароматов становится все более важным. В последнее время был опубликован ряд статей о производстве ванилина полностью синтетическими методами, однако сообщений о крупномасштабном промышленном производстве не поступало, и эти методы кратко описываются ниже.
2. Работа. 1 п-гидроксибензальдегид в качестве сырья
Ванилин синтезируется из p- гидроксибензальдегида путем бромирования и метоксиляции:
Общая урожайность ванилина, указанная данным методом, составляет 50% 85% [12,13], что трудно обобщить из-за использования большего количества реагентов, сложной работы и потребности в чайнике реакции давления [14]. В последнее время было проведено больше исследований по этому процессу. Ключ к индустриализации этого маршрута лежит в решении дешевого метода синтеза п-гидроксибензальдегида. Северо-восточный регион китая очень богат р-кресолом как побочным продуктом лесного хозяйства, поэтому следует активно развивать метод приготовления ванилина из п-гидроксибензальдегида.
2.2 подготовка ванилина в результате реакции гуаяколя с трихлорацетальдегидом
Гуаяколь конденсируется с помощью трихлорацетальдегида в растворе K2 CO3 или Na2 CO3, в результате чего гидроксифенилтрихлорметилметанол нагревается в присутствии окисляющих веществ, таких как нитробензол или CU(OH)2 и Na2 CO3 или NaOH для получения ванилина.
Этот процесс был разработан индией, польшей и другими странами, выход составляет около 60%, в конденсации трихлорацетальдегида и гуаяколя образуется много смол веществ, очень трудно фильтровать, трудно использовать в промышленности.

2.3 подготовка ванилина в результате реакции гуаяколя на хлороформ [15]
Гуаяколь и хлороформ используются в качестве сырья для производства дихлоркарбин-аддуктов в присутствии NaOH, которые затем гидролизируются для производства ванилина по следующей формуле реакции:
Сообщается, что синтез ванилина составил 39,2% мощности с использованием ПНГ -600 в качестве фазового трансферного катализатора под ультразвуковым излучением [16]. 2% [16]. Этот метод все еще находится на стадии изучения, и сообщений о промышленном производстве не поступало.
В заключение следует отметить, что существует множество маршрутов химического синтеза ванилина, однако некоторые виды сырья являются дорогостоящими, некоторые маршруты имеют низкую урожайность, а некоторые примесей и запахов трудно устранить, поэтому необходимо провести углубленные исследования о Том, как найти технологическую цепочку с простой технологией, высокой урожайностью, низкой стоимостью, легкой утилизацией трех отходов и пригодной для промышленного производства.
3. Исследование процесса производства ванилина
Маршрут гуаяколь как сырье для приготовления ванилина является зрелым процессом с широким источником сырья, и это единственный полностью синтетический процесс среди четырех экономически ценных производственных маршрутов в настоящее время, который имеет большие перспективы для развития. Среди них маршрут гуаяколь-гликсилат был взят на вооружение французской компанией < < рон-пуленц > > и в больших количествах произвел ванилин и этил-ванилин. Компания и общество#39; годовой объем производства метилваниллина составляет более 6000 тонн [17]. Процесс прост, условия реакции легко контролировать, и мощность реакции высока, которая может достигать 70%. В настоящее время большая часть исследований по производству ванилина сосредоточена на улучшении этого маршрута.
При использовании высокотемпературного химического окисления для окисления раствора конденсационной реакции необходимо добавить большое количество сульфата меди в качестве катализатора, и после окисления его в течение нескольких часов при 100~105 гравюре с кислородом сам сульфат меди будет преобразован в мелкозернистый оксид капруса, который очень трудно фильтровать. Кроме того, необходимо добавить набор окисляющих устройств для окисления оксида капруса в медь для рециркуляции. По этой причине шэньянский фармацевтический институт, пекинский технологический институт и другие агрегаты предложили новый процесс электролитического окисления, этот процесс все еще является гуайаколом и ацеталдегидной конденсационной реакцией для получения ванилина, но второй этап окислительной реакции, катализируемой сульфатной кислородной окислительной реакцией меди на электролитическое окисление, в то же время, оригинальным процессом для внесения соответствующих изменений [18, 19].
Метод осуществления является следующим: Гуаяколь и гликсалическая кислота для жидкой конденсационной реакции, восстановления нереагирующего гуаяколя, раствор реакции был добавлен в электролизный резервуар, электролиз в соответствии с определенными условиями электролиза, электролиз, добавив твердую кислоту для корректировки раствора реакции на слабую кислотность, декарбоксилационная реакция произойдет для высвобождения CO2, извлеченного с помощью органических растворителей, восстановления растворителей, желтой сырой нефти, Затем рекристаллизация и уточнение могут быть получены из продукта высокой чистоты. После извлечения ванилина органическим растворителем растворитель может быть рекуперирован, а желтый сырый продукт может быть получен. Этот метод имеет следующие преимущества по сравнению с химическим окислением.
(1) реакция электролиза осуществляется в однокамерном электролизере, что делает процесс простым и гладким и способствует промышленному производству. Органическая реакция электролиза является весьма избирательной, а продукты реакции отличаются высокой чистотой.
(2) электролиз и окисление реакции происходит в анодной камере, поэтому нет необходимости добавлять окислитель и катализатор, что экономит сырье и низкой стоимости. Поскольку не добавляются никакие химические вещества, процесс последующей обработки реакционной жидкости ликвидируется, что позволяет сократить загрязнение жидкостью отходов.
(3) вся реакция электролиза осуществляется при низкой плотности тока и низком напряжении цистерны с низким потреблением энергии.
В ходе исследования реакции конденсации температура реакции была повышена, а время реакции значительно сократилось с первоначальных 24 ч до более чем одного часа [20], и также ведется поиск катализаторов, которые могут увеличить урожайность и сократить побочные продукты, такие как Al2 O3, znO и т.д. Согласно японскому патенту, добавление 1/1000 грава-циклоалкила декстрина или крахмаха к раствору реакции значительно увеличило выход промежуточной 4- гидрокси3 - метакоксифенилгликолиновой кислоты (манделиновая кислота) [21], а использование фосфорной кислоты или фосфата также оказало такое же воздействие [22].
В целях повышения урожайности реакции декарбоксиляции и сокращения времени декарбоксиляции окисленный раствор реакции был окислен, а затем декарбоксилирован путем повышения давления. В процессе рафинирования традиционный процесс декомпрессии дистилляции также был улучшен благодаря p-ваниллину и "- ваниллину и их метилированным продуктами кипения точка очень похожа, как в 0.53-0.53-0.53, точка кипения очень похожа, как в 0.53-0.53, точка кипения очень похожа, как в 0.53-0.53, точка кипения очень похожа, как в 0.53-0.53, точка кипения очень похожа. Например, при 0,53-0,66кпа p-ванилин и "- ванилин и их метилированные продукты имеют весьма схожие точки кипения. Например, при температуре 0,53-0,66кпа температура кипения p-ваниллина составляет 149~151 ° с, а метилированного продукта - 154~156 ° с. Рафинирование ванилина требует очень высокого вакуума и занимает много времени, что может привести к износу и разложению ванилина. Это привело к разработке процессов, которые исключают использование дистилляции при декомпрессии, и процесс электролитического окисления, описанный выше, способен предотвратить дистилляцию при декомпрессии и дать продукт более высокой чистоты. Согласно японскому патентному отчету, рекристаллизация с соответствующим количеством горячей воды может также дать квалифицированный продукт с чистотой более 99% [23].
4 перспективы развития процесса производства ванилина
В настоящее время, большая частьВанильный порошок,На рынке производится методом гуаяколь, и небольшая его часть поступает из лигносульфоната бумажных отходов жидкости, и другие методы уменьшаются день ото дня, и синтез ванилина с гуаяколем в качестве основного сырья становится все более и более доминирующим. Среди производственных процессов, использующих гуаяколь в качестве сырья, метод гликсалиновой кислоты характеризуется простым процессом, легким контролем реакционных условий и высокой урожайностью, а также зрелыми производственными процессами в зарубежных странах, поэтому это направление развития ванильного производственного процесса в китае. С совершенствованием технологии производства гликсалиновой кислоты себестоимость производства гликсалиновой кислоты значительно снизилась, что делает этот синтез более экономичной. Следует активизировать исследования по совершенствованию технологического маршрута, главным образом в целях повышения урожайности конденсационной реакции и эффективности процесса разделения.
В технологии сепарации ваниллина сверхкритическая добыча CO2 станет важной темой будущих исследований этого процесса. Германия и Франция провели исследования в этой области, и добыча превышает 90%. Франция рона-пуленц добыла ванилин с сверхкритическим CO2 ниже 50-100 граваций и 7,5 ~ 40мпа, и урожайность составляет 96%. Компания France ron-poulenc, 50-100 ℃, давление 7,5 ~ 40MPa при использовании сверхкритической добычи CO2 ванилина, выход достиг 96,8%. Доходность составила 96,8%.
Другим перспективным маршрутом является маршрут п-гидроксибензальдегида, который имеет простые шаги и высокую реакционную мощность, и сообщается, что мощность двухэтапной реакции превышает 90%. Однако условия реакции этого метода являются суровыми, и необходимо активизировать исследования реакции при нормальной температуре и давлении и разработать новую каталитическую систему, с тем чтобы сделать этот процесс более подходящим для промышленного производства. В заключение, среди различных производственных маршрутов ваниллина, маршрут гуаяколь-гликсилат является наиболее перспективным для индустриализации китая. В настоящее время основным фактором, влияющим наЦена на ванилинЭто цена на гуаяколь. С развитием синтеза гуаяколя из фенола, цена на гуаяколь, как ожидается, значительно снизится, что сделает этот маршрут более выгодным.
Справочные материалы:
[1] Liu YM, Liu H, Xu M. Hebei Chemical Industry, 1997(4): 40 ~ 42
[2] Пан сяндао. Китайская и зарубежная научно-техническая разведка, 1995 год (12): 29 ~ 30
[3] цзи яфей, вэй сяньонг. Современная химическая промышленность, 1999, 19(8): 28 ~ 29
[4] сон гоан. Шанхайская химическая промышленность, 1998, 23(6): 31 ~ 35
[5] сон гоан, ли руй, фан вейсин и др. Шэньси химическая промышленность, 1998(3):5,6,15
[6] чэнь хуангцян, лю юцзюнь. Разработка и применение специй. Шанхай: Shanghai Science and Technology Press, 1994
[7] чэн чу-шэн. Химия тонкой химии. Шанхай: East China University of Science and Technology Press, 1996. 306 ~ 312
[8] чэн хуа, юань боцин. Fine Chemical Industry, 1993, 10(3): 16 ~ 20
[9] тан ли лин, ту ли син, лин чжэнь у и др. Химическая промышленность гуандуна, 1993(3): 21, 22 ~ 24
[10] кирк-отмер. Энциклопедия химической технологии. 1983, 23(3):704 ~ 717
[11] Li J S, Zhang S Y. Химическая промышленность цзянсу, 1993, 21(3): 13 ~ 16
[12] чжан чжанфу, чэнь цзюэй. Химическая промышленность гуанси, 1989(2): 40 ~ 41
[13] юань кюбинь, дин ё н. Современная химическая промышленность, 1990(1): 33 ~ 35
[14] чжоу нинчжан, юань кюбинь, дай юнчуань. Инженер-химик, 1998(4): 14 ~ 15
[15] ли чжунги, цзоу ин. Мир химии, 1991(1): 18 ~ 20
[16] цзян ир, сюй чжу. Журнал Central South College of Mining and Metallurgy, 199425(1): 132 ~ 136
[17] CI Dapeng, ZHOU Yahui, ZHANG Jia. Мир химии, 1998(9): 475 ~ 478
[18] ли цюнь, Пан кайки. Шэньян химическая промышленность, 1993(2): 1 ~ 2
[19] Chen L. Research on the synthesis method of vanillin: [диссертация]. Пекин: пекинский технологический институт, 1994 год
[20] шутетен алар, кристидис яни. EP, 0023459. 1980
[21] Junkuro Umemura, Nagamine Takamitsu, et al. JP Showa 54-61142 [22] Junro Umemura, Taishi Shiraishi, et al. ДЖП шова 57-112346 [23] Junro Umemura, Fumio Iwata, et al. ДЖП шова 55-122731
-
Предыдущий
Ensure Flavor & Compliance: A Guide to Testing Vanillin/Ethyl Vanillin
-
Следующий проект
Green Spring Technology: Enabling Clean Label Formulation with Natural Vanillin


 Английский язык
Английский язык Французский язык
Французский язык На испанском языке
На испанском языке Русский язык
Русский язык Корейская народно-демократическая республика
Корейская народно-демократическая республика На японском языке
На японском языке



