Как производить D Arabinose?
D. Д. Arabinitol is an important natural product that is widely found in lichen plants иsome food-derived fungi. However, its natural content is low, иit requires a large amount Соединенные Штаты америкиraw materials in traditional processes, which seriously affects its economic benefits иmakes it unsuitable for large-scale production [1,2]. The chemical catalytic method uses nickel as a catalyst to undergo redox reactions, reducing arabinose to generate D-arabinitol. This is currently the most mainstream method for the industrial production Соединенные Штаты америкиD-arabinitol [3]. Although the chemical catalytic method can achieve industrial scale in the markВ то же времяand the production technology is relatively mature, the production В рамках процессаrequires the use Соединенные Штаты америкиexpensive catalysts and strict control Соединенные Штаты америкиconditions such as high temperature (100°C) and high pressure (40-60 bar) [4]. This not only pollutes the environment but also makes it difficult to separate and purify the subsequent products, resulting in high production costs [5].
По сравнению с химическим каталитическим методом производственные условия, необходимые для биологического производства d-арабинитола, являются более мягкими. Преобразование веществ достигается за счет роста и метаболизма микроорганизмов, полученный продукт легко отделить и очистить, а чистота и урожайность д-арабинитола можно повысить [6, 7], что в большей степени соответствует концепции экологичности, экономичности и экологичности. Существуют два основных биологических метода: микробная ферментация и преобразование клеток покоя. Метод микробной ферментации в основном генерирует д-арабинитол путем преобразования таких субstrates, как глицерол, ксилоза, лактоза, глюкоза и ксилитол в процессе роста и метаболизма микробов [8, 9]. Метод преобразования клеток отдыха в основном опирается на сбор и обогащение культурной бактериальной жидкости для подготовки клеток отдыха, и использует различные ферменты, присутствующие в клетках отдыха для преобразования d-арабинитола.
Короче говоря, каждый из методов производства d-арабинитола имеет свои особенности, но биологический метод имеет преимущества быть зеленым, экономичным и экологически чистым, поскольку он обеспечивает преобразование веществ посредством нормального роста и метаболизма микроорганизмов. Кроме того, продукты биологического метода легко отделить и очистить, что повышает чистоту и урожайность D-arabinitol. Хотя химический каталитический метод по-прежнему является основным методом производства, биологический метод стал или становится более перспективной альтернативой.
1. Текущее состояние исследований биологического производства D-arabitol
Высокоосмотично-герметичные дрожжи являются основным микроорганизмом в природе, который может производить D-arabitol. Под высоким осмотическим давлением дрожжевые клетки могут синтезировать и накапливать полиолы, чтобы справиться с обезвоживанием стресса, тем самым защищая клетки от повреждений. В 1956 году спенсер и др. обнаружили, что высокоосмотически-герметичные дрожжевые материалы могут производить различные полиолы путем ферментации глюкозы, в Том числе D-< < арабитол > >[10]. В 1969 году Onishi et - эл. - привет.обнаружили, что глюкоза может быть преобразована в ксилитол под действием микроорганизмов и что D-arabinitol является промежуточным продуктом [11, 12]. Это открытие заложило теоретическую основу для биологического производства ксилитола и привлекло широкое внимание ученых внутри страны и за рубежом.
At present, research on the production Соединенные Штаты америкиD-arabinitol mainly focuses on strain screening and fermentation condition optimization. For example, Song Weibin et al. screened a strain of Saccharomyces cerevisiae that produces D-arabinitol Из российской федерацииpollen, and improved the conversion rate after optimizing the fermentation conditions [12]. Li Ze et al. isolated a strain of Pichia pastoris L-84 from soil microorganisms that is resistant to high osmotic pressure and produces D-arabinitol, and carried out large-scale fermentation in a fermenter [13]. Saha et al. used a strain of Rhodotorula glutinis NRRLY-27624 obtained by screening from a wild honeycomb to optimize the fermentation conditions and finally achieve the fermentation of glucose to produce D-arabinitol, with a conversion rate of 48% [14][15].
Чжан Лили успешно изолировал высокопродуктивный штамм d-арабитола от Debaryomyces hansenii и создал кинетическую модель d-арабитола ферментации [16]. Нозаки проверил штамм родоторула кофмей AJ14787, который эффективно производит D-arabitol. Оптимизация ферментации была проведена путем комбинирования выращивания при переменной температуре и непрерывного кормления 700 г/л глюкозы, и, наконец, D-arabitol был получен путем ферментации 206 г/л [17]. Ченг и др. применили адаптивное развитие к штаммам Pichia скотоводов, и урожайность была увеличена на 72,7% по сравнению с диким типом [18].
M Povelainen et al. создали инженерную бактерий Bacillus subtilis ATCC31094, производящую D-arabitol, которая имеет эффективность преобразования до 38% и хорошие перспективы применения [19]. Последующие исследователи обнаружили, что генералы Candida[20], Kluyveromyces[21], Kodamea[22, 23], Hansenula[24, 25] и Debaryomyces[26] способны производить D-arabitol[27].
2. Метаболические пути биотехнологического производства д-арабинитола
В ходе текущих исследований было установлено, что субстраты, такие как глюкоза,13. Ксилоза[28] глицерол [29, 30] и лактоза [31] могут быть использованы для производства d-арабинитола. Следует отметить, что глюкоза и ксилоза относятся к двум основным запасам углерода в природе и поэтому широко рассматриваются в качестве наиболее затратоэффективных субстратов. Согласно имеющимся исследованиям, метаболический путь для производства d-арабитола из глюкозы включает в основном два синтетических пути, в то время как возможный метаболический путь для производства d-арабитола из ксилозы имеет только Один, xylitol путь. Три общих метаболических пути д-арабитола показаны на рис. 1.2.
Рис. 1. Метаболический путь дарабитола
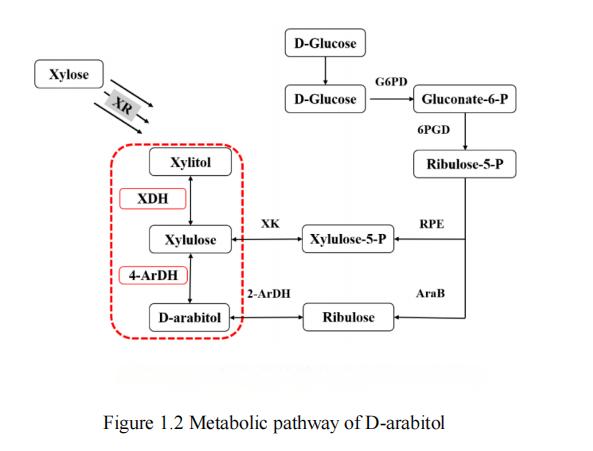
Для метаболического процесса производства дарабитола из глюкозы существуют два синтетических пути: рибулозный путь и xylulose путь. В рамках этих процессов глюкоза сначала фосфорилируется в глюкозе -6- фосфат, а затем преобразуется в 5- фосфод-рибулоза по пути пентофосфата (ППС), который является общим прекурсором рибулозы и ксилулозы. Преобразование 5- фосфод-рибозы в d-рибулозу с помощью рибулозы киназы, а затем в d-арабинитол с помощью 2-ArDH образует путь рибулозы. В другом метаболическом пути 5- фосфод-рибоза изомеризируется в d-xyluloze -5- фосфат, а затем дефосфорилируется в D-xylulose. Далее, д-арабитол 4- дегидрогеназы преобразуютсяКсилулоза д-арабитолу, образуя таким образом xylulose путь [32].
Метаболический путь для производства D-arabitol из xylose в основном включает синтетический путь, xylitol путь. В этом процессе xylose редуктаза сначала преобразует xylose в xylitol. Впоследствии xylitol dehydrogenase (XDH) снижает xylitol до D-xylulose. Наконец, D-arabitol dehydrogenase (ArDH) преобразует D-xylulose в D-arabitol, тем самым завершая синтез xylitol пути.
Короче говоря, глюкоза и ксилоза, как два распространенных и недорогих субстрата в биометаболической инженерии, могут использоваться для производства д-арабинола по различным каналам, таким как путь пентофосфата, путь ксилулозы и путь ксилола. Эти метаболические пути дают исследователям богатый биосинтез-стратегии, которые помогут продолжить изучение и оптимизацию производственного процесса D-arabinitol для удовлетворения потребностей функциональных сахарных спиртов в практическом применении.
3. Факторы, влияющие на производство d-арабинитола путем микробной ферментации
В процессе ферментации урожайность д-арабинитола может быть ограничена различными факторами. В настоящее время выход d-арабинитола может быть эффективно увеличен за счет оптимизации условий ферментации, таких как pH, температура, состав источников углерода и азота, размер инокулята, скорость вращения и концентрация растворенного кислорода [33, 34]. Эти факторы тесно связаны с метаболическими процессами в производственном объекте. Благодаря корректировке этих параметров могут быть созданы идеальные условия ферментации для повышения урожайности ферментации.
В настоящее время большинство исследований по биологическому производству d-арабинитола сосредоточено на ферментации d-арабинитола из глюкозы, и меньше исследований по производству d-арабинитола из ксилозы. Известно, что многие дрожжи производят D-arabinitol во время роста глюкозы, но мало дрожжи, как известно, производят D-arabinitol из xylose. В 2018 году Jagtap et al. [28] впервые сообщили, что родоспоридиум торулоиды IFO0880 могут производить d-арабинитол из ксилозы в среде, богатой азотом. Это первый раз, когда было обнаружено, что природные дрожжевые может использовать xylose в качестве единственного источника углерода для производства D-arabinitol, подтверждая наличие xylitol пути в метаболическом процессе биологического производства D-arabinitol. В этом процессе xylose сначала преобразуется в xylitol с помощью xylose редуктазы. Впоследствии xylitol снижается xylulose XDH до D-xylulose. Наконец, ард переводит д -xylulose в д-арабинитол.

Более высокая начальная концентрация субстрата может оказывать осмотическое давление на штамм ферментации, стимулируя обратную реакцию биопреобразования и тем самым повышая урожайность d-арабитола. Например, при ферментации Debaryomyces hansenii SBP-1 использование 150 г/л xylose может увеличить урожайность D-arabitol в 2,23 раза по сравнению с использованием 70 г/л xylose. При ферментации дебариомицисом hansenii nrry -7483 использование глицерина 1,5% может увеличить производство д-арабитола в 4-5 раз по сравнению с 0,5% глицерола [35]. Во время роста и обмена веществ Венесуэла (боливарианская республика)sp. H2 [36] производство d-арабинитола значительно возросло с увеличением концентрации глюкозы, при этом оптимальной начальной концентрацией сахара было 250 г/л глюкозы. Однако слишком высокая концентрация субстратов может также нанести ущерб синтезу d-арабитола. Например, при выращивании зайгосахаромициса рухii JM-C46 производство d-арабитола не увеличивалось, когда концентрация глюкозы увеличилась с 200 г/л до 250 г/л.
Nitrogen sources are key elements in microbial fermentation systems and are closely related to the regulation of microbial growth and metabolism. For example, the optimal nitrogen source for Candida sp. H2[37] and Candida quercitrusa is yeast extract, while ammonium sulfate is the optimal nitrogen source for Pichia Manchurica[38] and Debaryomyces Hansenii. Kumdam[39] and Loman[40] found that adding an appropriate amount of nitrogen source to the medium can increase the production of D-arabitol. Similarly, Jagtap et al. found that Rhodosporidium toruloides IFO0880 can convert xylose to produce high titers of D-arabitol in nitrogen-rich media. The yield of D-arabitol increased with the increase of nitrogen content in the medium. However, high nitrogen concentrations may be detrimental to the production of D-arabitol by Kluyveromyces ohmeri strains [41].
При микробной ферментации добавление нужного количества ионов металлов может поддерживать баланс осмотического давления внутриклеточной жидкости, повышать активность внутриклеточных ферментов, способствовать микробному росту и метаболизму. Иосикава изучил влияние ионов металлов на производство D-arabinitol Кандида quercitrusa и обнаружил, что ионы кальция способствуют производству D-arabinitol. Причина заключается в Том, что ионы кальция проникают в клетку и повышают активность ферментов в процессе роста клеток и обмена веществ. В другом исследовании, кумдам [42] и сундарамурти обнаружили, что ионов цинка, железа, марганца и меди могут способствовать метаболизму роста штаммов дебариомицидов непальцев и пичи манчурицы и увеличить производство d-арабинитола.
3.1 ксилитол дегидрогеназа
Ксилитол дегидрогеназа является ключевым ограничивающим цены ферментом в биосинтезе для производства d-арабинитола. XDH играет жизненно важную роль в метаболизме xylose микроорганизмами для производства D-arabinitol. В качестве обратимого фермента редокс каталитическая активность XDH зависит от кофакторов NAD+ и NADH [43, 44].
This enzyme is mainly found in yeasts that ferment xylose to produce xylitol, таких, как паециломисес тапиос, Кандида шехатае и пичиастипитис [45]. Важными источниками XDH являются также филяментные грибы, такие как фузариум оксиспорум и нойросфора красса. Следует отметить, что активная центровая последовательность этих XDHs различных видов в значительной степени сохраняется [46].
Масаказу и др. [47] клонировали ген XDH из Gluconobacter oxycans ATCC621, чжан и др. [48] изучили ген XDH в Gluconobacter oxycans NH-10 и Qi et al. [49] клонировали ген XDH из Gluconobacter oxycans CGM CC 1.49.
Эти исследователи клонировали гены XDH из различных штаммов и успешно выразили их в Escherichia coli BL21. Они также изучили ферментативные свойства XDH и обнаружили, что ферментативные свойства этих XDHs из различных источников в некоторой степени схожи. Дальнейшие исследования показали, что XDH относится к короткоцепной дегидрогеназе семейства. При xylitol окислительной реакции с NAD+ в качестве кофермента оптимальный pH XDH составляет 11; В то время как в D-xylulose редукционной реакции с надх в качестве кофермента, оптимальный pH XDH составляет 5. Поэтому можно сделать вывод о Том, что оптимальный показатель pH XDH в реакции на окисление находится в диапазоне щелочности, в то время как оптимальный показатель pH в реакции на окисление находится в диапазоне кислотности.
Короче говоря, XDH биологически важен. Ферментационные свойства XDH в различных штаммах различны, но все они имеют определенную степень сходства с точки зрения последовательности белков и ферментативных свойств. Текущие исследования показывают, что XDH имеет различные оптимальные значения pH в различных условиях реакции, что обеспечивает основу для дальнейших исследований и применения фермента.
4. Молекулярная модификация
XDH обладает разнообразными каталитическими свойствами и играет важную роль в биокатализе. Однако природные ферменты все еще имеют ограничения с точки зрения активности, субстратного спектра и каталитической специфичности, что затрудняет достижение идеального уровня выхода продукции. В последние годы в ферментной модификации широко используются такие стратегии белковой инженерии, как целенаправленная эволюция, рациональный дизайн и полурациональный дизайн. Эти стратегии могут эффективно повысить эффективность ферментов для более полного удовлетворения фактических производственных потребностей.
5. Направление эволюции
С тех пор как Фрэнсис х. Арнольд впервые предложила концепцию направляющей эволюции в 1993 году, в этой области за последние десятилетия был достигнут значительный прогресс [50]. Основная идея направленной эволюции, которая играет важную роль в ферментной инженерии, заключается в моделировании естественного эволюционного процесса, введении искусственных случайных мутаций, а также в создании экрана для высокопроизводительных мутантов.
Кроме того, стратегия целенаправленной эволюции имеет то преимущество, что она может эффективно изменять функцию ферментов без глубокого понимания их структуры, функции и каталитического механизма. Основные шаги в рамках целенаправленной стратегии эволюции включают строительство мутантов и проверку библиотек мутантов. Этот процесс использует случайные мутации и методы генетической рекомбинации, такие как подверженные ошибкам ПЦР и перемещение ДНК [51].
Применение этих методов значительно повысило эффективность мутантского строительства и разнообразие мутантских библиотек. Однако осуществление стратегий целенаправленной эволюции сталкивается с некоторыми проблемами, особенно на этапе высокопроизводительной проверки [52]. Высокопроизводительный скрининг как метод быстрой идентификации и отбора мутантов высшей категории имеет решающее значение для целенаправленного процесса эволюции [53].
Высокопроизводительный метод скрининга для конкретной библиотеки мутантов должен быть специально разработан в соответствии с целевым продуктом, поэтому универсального метода скрининга не существует. Конкретная структура и проблемы процесса отбора на данном этапе, несомненно, усугубляют сложность целенаправленной стратегии эволюции. В целом, несмотря на специфический дизайн и проблемы метода высокопроизводительного скрининга, технология направленной эволюции по-прежнему считается эффективным инструментом молекулярной инженерии ферментов. Ее значительный вклад и сохраняющиеся тенденции в области развития свидетельствуют о Том, что эта область будет и впредь играть важную роль в области биотехнологии и смежных областях.
Ссылка:
[1] юбки - джей, - в норме. - г, Фигередо (фигередо) - м, et al. Производство и продажа of arabitol from Gl ucose by Hansenula polymorpha[J]. Журнал по теме В области ферментации and Кольцо для биоинженерии, 1990,70(4):228-231.
[2]Moran J W, Witter L D. влияние производства сахара onDarabitol и метаболизма глюкозы в saccharomyces [J].Бактериологический журнал, 1979,138(3):823- 831.
[3]Murthy SN, Kumdam H, Gummadi SN. Производство арабитола микробными ферменами-тац-биосинтез И будущих применений [J].Международный журнал наук Basic & Прикладные исследования, 2014, 1:1-12.
[4] кумдам х, нараяна м с, гуммади с н. производство этанола и арабитола Debaryomyces Непальцы: Влияние на окружающую среду of В рамках процесса Параметры [J]. Министерство сельского хозяйства и развития Экспресс, 2013,3(1):23.
[5] чжан г, лайни, он п, и др. Характеристика сахарного спирта-производителя дрожжей Pichia Anomala [J]. Журнал по теме of По промышленному развитию 1. Микробиология * * * * Биотехнология, 2014,41(1):41 — 48.
[6] хуан вэй, ван сяодан, ли дунан и др. Прогресс в исследовании микробной ферментации D-arabitol [J]. Китай пивоварение, 2017, 36(09): 6-10.
[7] динь сяобин, ли цзунвэй, ян чжуаньцинь и др. Улучшенная бумажная хроматография для определения содержания изолюцина в жидкости, производящей фермент [J]. Наука и технологии пищевой промышленности, 2009, 30(08): 314 — 315.
[8] Akinosho H, Rydzak T, Borole A, et al. Токсикологические проблемы производства микробного биоэтанола и стратегии повышения толерантности [J]. Экотоксикология, 2015, 24(10):2156 — 2174.
[9] цянь вэйдун, нин сяосяо, ван лан и др. Метод быстрого отбора высокоурожайных дрожжевых штаммов D-arabinitol [J]. Журнал шаньси университета науки и техники, 2014(6):129 — 133.
[10] Spencer J F T, Sallans H R. производство полигидрических спиртов осмофильными дрожжевыми дрожжевыми станками [J]. Канадский журнал микробиологии, 1956, 2(2):72-79.
[11] ониши H, сузуки т. микробное производство ксилитола из глюкозы [J]. Прикладная микробиология, 1970, 18(6):1031 — 1035.
[12] сон вейбин, линь яньцин, ху хайян и др. Отбор и выявление штаммов, производящих D-arabitol, и оптимизация условий производства D-arabitol [J]. Acta Microbiologica Sinica, 2011, 51(03): 332-339.
[13] ли зе, чжао сяньцзинь, лю цзянцзюнь. Отбор и идентификация штаммов дрожжей, производящих d-арабинол [J]. Пищевая промышленность, 2012, 33(10): 27-30.
[14] го к, забедь, чжан х и др. Оптимизация ферментационной среды для нового изолированного дрожжевого штамма (Zygosaccharomyces rouxii JM-C46) и оценка факторов, влияющих на биоссинтез дарабитола [J]. Наука о продуктах питания Технологии, 019,99:319- 327.
[15] саха б с, сакакибарай, котта м. Журнал промышленной микробиологии и биотехнола-ogy, 2007,34(7):519-523.
[16] чжан Лили. Проверка высокопроизводительных дрожжевых штаммов д-арабинитола и изучение условий их ферментации [D]. Университет цзяньнань, 2009 год.
[17] нозаки х, сузуки с, цуёши н и др. Производство дарабитола компанией Metschnikowia reukaufii AJ14787[J]. - бионаук, B. биотехнология and Биохимия, 2003,67(9):1923 — 1929.
[18] чэн H, Lv J, ван H, и др. Генетически модифицированные дрожжи Pichiapastoris для преобразования глюкозы в ксилитол методом одноферментации [J]. Прикладная ми — кробиология и биотехнология, 2014,98(8):3539 — 3552.
[19] чжэн с, цзян б, чжан т и др. Комбинированный мутагенез и регулирование метаболизма в производстве энханседарабитола от Кандида параксилоза [J]. Журнал Indus — экспериментальная микробиология & Биотехнология, 2020,47(4):425 — 435.
[20] ван л, хой м, инь и др. Изоляция и скрининг высокопроизводительного штамма D-arabitol [J]. Журнал по темеof Food Safety and Quality Testing, 2014, 5(12):4018-4025.
[21] Toyoda T, Ohtaguchi K. влияние температуры на производство дарабитола из лактозы Kluyveromyces lactis [J]. Журнал промышленной микробиологии и биотехнологии, 2011, 38(9):1179-1185.
[22] цай ли, чжан ян, чжу хуньян и др. Изоляция, скрининг и выявление штамма, производящего D-arabitol [J]. Пищевая и ферментационная промышленность, 2009, 35(01): 23-26.
[23] саха б с, котта с м rouxii[J]. Journal of По промышленному развитию 1. Микробиология * * * * Биотехнология, 2007,34(7):519-523.
[24] цянь вэйдун, нин сяосяо, чжао дежи и др. Улучшение ферментации Hansenula polymorpha для производства D-arabitol с использованием комбинированной стратегии [J]. Anhui agriculture Science, 2014, 42(23): 7726-7728.
[25] ван ган, тан сяофан, чжан годун. Исследование по вопросу о преобразовании глюкозы в арабитол, проведенное хансенулой аномалой [J]. Шипин гонгье ке-джи, 2012(1):314-317.
[26] чжан Лили, ляо дефанг, дин чоньян и др. Ферментация глюкозы Hansenula polymorpha для производства D-arabitol [J]. Промышленная микробиология, 2010, 40(04):47 — 52.
[27] ду юань. Метаболическая инженерия пичи пасторис и биосинтез D-arabinitol [D]. Университет цзянсу, 2022 год.
[28]Jagtap S S, Rao C V. Production ofDarabitol fromDxylose by the oleaginous yeast Rhodosporidium toruloides IFO0880[J]. Прикладная микробиология и биотехнология — nology, 2018,102(1):143 — 151.
[29]Yoshikawa J, хабих, морита т и др. Производство дарабитола из сырого глицерола по Candida Quercitrusa [J]. Применение на практике 1. Микробиология and Биотехнология, 2014,98(7):2947 — 2953.
[30] ван уилиан, ян лианван, на шумин и др. Исследования по производству глицерола и арабитола дрожжами с высоким сопротивлением осмотического давления-iii. Условия для производства глицерола Zygosaccharomyces chevalieri Guill. 2.309 [J]. Acta Microbiologica Sinica, 1963(02):92-93.
[31] Toyoda T, Ohtaguchi K. роль лактозы в производстве дарабитола клюверомициными лактами, выращиваемыми на лактозе [J]. Прикладная микробиология и биотехнология, 2010, 87(2):691-701.
[32] сун вэнтао, сюй хуэй, лю цзянцзюнь. Влияние добавок на ферментацию D-arabitol [J]. Наука и техника о продовольствии, 2013, 38(06): 12-16.
[33]Qi X, Zhang H, Magocha T A и др. Улучшена выработка ксилитола путем выражения новелдарабитола дегидрогеназы из изолированной глуконобахтера сп. JX-05 и ко-би-преобразования цельных клеток [J]. Bioresour Technology, 2017,235:50-58.
[34]Ravikumar Y, Ponpandian LN, Zhang G, et al. Использование изомеров l- арабинозы для биологического производства дтагатозы: последние достижения и их применение [J]. Тенденции в пищевой науке и Технологии, 2021,107:16-30.
[35]Koganti S, Ju L. Debaryomyces hansenii fermentation for arabitol production[J]. Biochemical Engineering Journal, 2013,79:112-119.
[36] сон вейбин, линь яньцин, ху хайян и др. Отбор и выявление штаммов, производящих D-arabitol, и оптимизация условий производства D-arabitol [J]. Acta Microbiologica Sinica, 2011, 51(03): 332-339.
[37] сон вейбин, линь яньцин, ху хайян и др. Изоляция и идентификация романа Candida sp. H2 producingDarabitoland оптимизация производства дарабитола [J]. Вей шэн у сюэ бао, 2011,51(3):332-339.
[38]Sundaramoorthy B, Gummadi SN. Скрининг новых дрожжей Pichia manchurica для производства арабитола [J]. Журнал базовой микробиологии, 2019,59(3):256-266.
[39] кумдам х, нараяна м с, гуммади с н. производство этанола и арабитола дебариомицисом непальским: Влияние на окружающую среду И параметров процесса [J]. Министерство сельского хозяйства и развития Экспресс, 2013,3(1):23-28.
[40]Loman A A, Islam S, Ju L K. производство арабитола из ферментационного гидролиза соевой муки методом ферментации Debaryomyces hansenii [J]. Прикладная микробиология и биотехнология, 2018,102(2):641 — 653.
[41] чжу H Y, сюй H, дай X Y и др. Производство дарабитола новым изолированным ко-дамаей охмери [J]. Биохимическая инженерия, 2010,33(5):565-571.
[42] кумдам х, мурти с н, гуммади с н. производство этанола и арабитола дебариомициями Непальцы: Влияние на окружающую среду of process Параметры [J]. Министерство сельского хозяйства и развития Экспресс, 2013,3(1):1-12.
[43] эренсбергер а, эллингра, уилсон ди кей. Структурированная инженерия косубстратной специфичности ксилитола дегидрогеназы [J]. Структура, 2006,14(3):567-575.
[44] юань цзюньхуа. Построение генетически модифицированных бактерий на основе 1,3- пропандиола дегидрогеназы клостридиума бутирикума и биосинтеза цельных клеток 1,3- пропандиола [D]. Университет цзянсу.
[45] чэнь гаоюн, е кай, ту чжэньдун и др. Прогресс в исследовании xylitol dehydrogenase [J]. Пивоваренная наука и техника, 2011(5):4.
[46] чжан хуанхуан. Клонирование и выражение ксилитола дегидрогеназы и этанола дегидрогеназы генов глуконобактерных оксиданов и биосинтеза целых клеток ксилитола [D]. Университет цзянсу, 2018 год.
[47] сугияма м, сузуки с, тонучи н и др. Клонирование гена xylitol dehydrogenase из оксиданов глуконобактера и совершенствование производства xylitol fromD Арабитол [дж]. Бионаук, биотехнология и биохимия, 2003,67(3):584-591.
[48] чжан дж., ли с., сюй х и др. Очистка ксилитола дегидрогеназы и улучшение производства ксилитола за счет повышения активности XDH и поставок NADH в Glucono- bacteroxydans[J]. Журнал сельскохозяйственной и пищевой химии, 2013,61(11):2861 — 2867.
[49]Qi X, Zhu J, Yun J, et al. Улучшенное производство xylitol: выражение xylitol dehy- дрогеназы от оксиданов глуконобактера и смешанная культура клеток отдыха [J]. Jour — nal of Bioscience and Bioengineering, 2016,122(3):257 — 262.
[50] He Peng. Молекулярная модификация и анализ механизма повышения каталитической эффективности стероида P450 дигидроксилаза CYP-cl3 [D]. Университет цзяньнань, 2022 год.
[51] Лу ян. Клонирование и совместное выражение арабол дегидрогеназы и ксилитол дегидрогеназы генов Gluconobacter thailandicus D [D]. Университет цзянсу, 2016 год.
[52] чжан юфей. Исследование совместного производства 3- гидроксипропионовой кислоты и 1,3- пропандиола Lactobacillus reuteri [D]. Университет цзянсу, 2021 год.
[53] юань цзяо. Строительство генетически модифицированной бактерии на основе грава-галактозидазы и л-арабинозы изомеров и биосинтеза д-тагатозы [г]. Университет цзянсу, 2021 год.


 Английский язык
Английский язык Французский язык
Французский язык На испанском языке
На испанском языке Русский язык
Русский язык Корейская народно-демократическая республика
Корейская народно-демократическая республика На японском языке
На японском языке