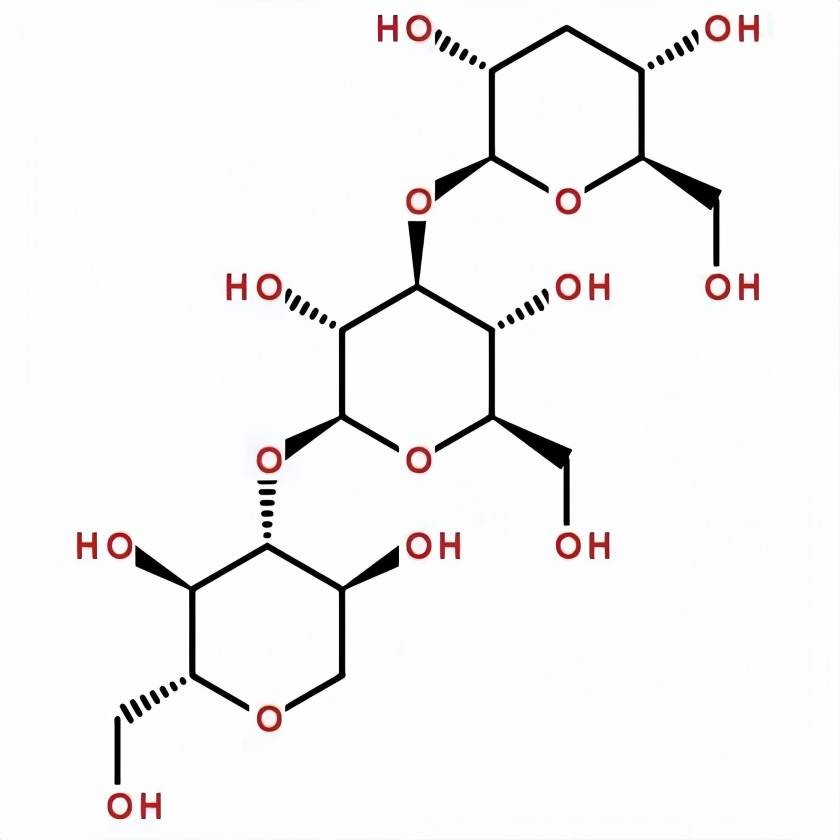
Что такое β 13 Glucan?
Бета -1,3- глюканЯвляется классом высокомолекулярных полисахаридов, широко распространенных в природе, с главной цепью глюкозы единиц, связанных бета -1,3- гликоцидных связей. Некоторые естественные β 1,3- глюканы также содержат боковые цепи, связанные β 1,6- гликосидические связи в различных пропорциях и размерах. Например, боковые цепи фукоидана из коричневых водорослей содержат около 30% грау -1,6- связанные разветвленные конструкции и поэтому водорастворимы [1]. Природные β-1,3- глюканы широко распространены в грибах, бактериях и растениях. Общие 1,3- глюканы включают в себя fucoidan, carrageenan, дрожжевой глюкан, пория кокос полисахариды, shiitake грибы полисахариды, кальлозы и т.д. Из-за того, как соединены связи β 1,3- гликосидические и водородные связи между молекулами, длинноцепные β 1,3- глюканы обычно демонстрируют различные спиральные третичные структуры в их естественном состоянии [2]. Эти специальные третичные структуры наделяют β 1,3- глюканов разнообразными биологическими функциями, включая регулирование иммунитета [3], содействие распространению пробиотики кишечника [4], регулирование баланса сахара в крови и снижение уровня холестерина [5]. Биологическая деятельность β 1,3-glucan и ее специальная третичная структура привлекли широкое внимание в области продовольствия, ежедневных химических веществ и медицины.
β-1,3-glucanase is A/данные отсутствуют.class of enzymes that can hydrolyze glucan linked by β-1,3-glycosidic bonds, and plays an important role В случае необходимостиthe biodegradation, reconstruction, and development and application of β-1,3-glucan. In nature, β-1,3-glucanase is widely distributed in archaea, bacteria, fungi, higher plants and animals. β-1,3-glucanase has a wide range of applications in the food and pharmaceutical industries, such as the preparation of low molecular weight β-1,3-glucan oligosaccharides, reducing the viscosity of beer fermentation broth, and inhibiting post-harvest pathogenic fungi in fruits and vegetables.
Хотя исследователи провели много исследований по экспрессии и очистке, молекулярной структуре, ферзиматическим свойствам и каталитическому механизму β 1,3-glucanase, сложная структура различных типов β 1,3-glucan ограничивает ее широкое применение. Синергическое участие тбо -1,3- глюканазов из различных семейств и с различными способами действия необходимо для эффективной деградации сложных тбо -1,3- глюканов. Таким образом, глубокое понимание структуры, функции и каталитического режима различных типов β 1,3- глюканаз имеет большое значение для применения и дальнейшей молекулярной модификации β 1,3- глюканаз. В настоящем документе содержится краткая информация о ходе исследований в области структуры, функций и областей применения типичных глюканазов тз -1,3 с целью обеспечения основы для последующих исследований их каталитических механизмов и их применения в области продовольствия, медицины и других областях.
1 классификация грау -1,3 глюкана и их каталитических механизмов
β-1,3 глюканазы могут быть разделены на эндотип и экзотип в соответствии с их каталитическим режимом. Endo-β 1,3-glucanase (EC 3.2.1.39), также известный как kombu polysaccharide enzyme, представляет собой фермент, который конкретно гидролизирует β-1,3- гликозидные связи в β-1,3-glucan sugar chains. Он играет ключевую биологическую роль в разложении и реконструкции грау -1,3- глюкан в природе и является семьей. Эндо1,3- грац-глюканаз гидролиз -1,3- глюкан изнутри сахарной цепи, производя серию олигосахаридов с различной степенью полимеризации. Exo-β-1,3- глюканаза (EC 3.2.1.58) гидролизирует β-1,3- глюканский субстрат Один за другим из неснижающегося конца сахарной цепи. Гидролизованные продукты, как правило, являются глюкозой или однократным олигосахаридом, и они играют вспомогательную роль в деградации β 1,3-glucan. Основываясь на эволюционных связях, обнаруженные β 1,3- глюканазы можно разделить на 12 гликозидных гидролазов (гх) в соответствии с базой данных CAZy (http://www.cazy.org/). Среди них endo-β 1,3- глюканазы можно разделить на 9 гх семей (рис. 1): г16, г17, г55, г64, г81, г128, г152, г157 и г158; Exo -β-1,3- глюканазы, которые были обнаружены, можно разделить на 6 гх семей: г3, г5, г17, г55, г128 и г132.
β-1,3- глюканазы имеют два механизма гидролиза, а именно консервативный механизм и обратный механизм [6]. Каталитический процесс сохраняемого механизма гидролиза состоит из двух этапов. Во-первых, глютамическая кислота остатков в активном центре действует как общая кислота (донор электронов), чтобы обеспечить протон кислорода гликосидической связи, чтобы удалить группу выхода, сломать β-1,3- гликосидической связи, и сформировать фермент-гликозидный промежуточного продукта.
Впоследствии глютамическая кислота, остающаяся в активном центре, выступает в качестве широкой основы, помогая молекуле воды в борьбе с гетероатомным углеродом фермент-гликозидного промежуточного вещества. Наконец, грава -1,3- гликозидная связь субстрата гидролизируется, образуя конечный гидролитический продукт. Механизм удержания так называется, потому что конформация субстрата сохраняется двумя инверсиями гетероатомного углерода. Инвертирующий механизм 1,3- глюканазы включает два сохраняемых каталитических остатка, общую кислоту и общую основу. Во время реакции общая кислота сначала подает протон аномерному углероду субстрата, в то время как общая основа удаляет протон из молекулы воды, повышая его нуклеофиличность и способствуя его атаке на центр аномерной группы, тем самым разрывая гликосидическую связь и генерируя гидролитический продукт (рис. 2).
2. Источники и подготовка 1,3- глюкана
β-1,3-glucan is mainly derived from fungi, bacteria, plants, insects and molluscs. Table 1 summarizes the typical β-1,3-glucanases from different sources that have been reported to have application potenti- эл. - привет.The main bacteria that have been reported to produce β-1,3-glucanase are Pyrococcus furiosus [7], Paenibacillus polymyxa [8], Bacillus lehensis G1 [9], Streptomyces sp. [10], etc. Fungi and plants are also important sources of β-1,3-glucanase, including Aspergillus fumigatus [11], Trichoderma asperellum [12], Phanerochaete chrysosporium [13], barley [14], grapes [15], etc.
Natural sources of β-1,3-glucans are abundant, stable in nature, and exhibit specific catalytic activity, showing unique application potential. For example, β-1,3-glucanase produced by Paenibacillus terrae [16] can effectively inhibit the growth of plant pathogenic fungi and play an important role in plant protection. β-1,3-glucanase derived from Arca inflata [17] has β-1,3-glucanase has high activity and exhibits an immune-enhancing effect on tumor necrosis factor.
β-1,3- глюкан из Trichoderma harzianum [18] является идеальным кандидатом фермента для производства β-1,3- олигосахаридов и может быть использован для промышленной подготовки олигосахаридов. В дополнение к открытию β-1,3- глюканазы с отличными свойствами из природных источников, гетерологические технологии рекомбинантного выражения могут также использоваться для обнаружения и подготовки β-1,3- глюканазы, тем самым расширяя их источники, повышая уровень выражения и расширяя сферу применения β-1,3- глюканазы.

В настоящее время основными носителями рекомбинантного выражения β-1,3-glucan являются Escherichia coli, Pichia is, Bacillus subtilis и т.д. Система экспрессии E. coli является более технологически зрелой и относительно простой в эксплуатации, чем система экспрессии дрожжей, и широко используется при открытии и подготовке новых β 1,3-glucan. Например, β-1,3-glucan из таких источников, как антагонистические дрожжи Pichia guilliermondii [19], макрогеном музы rumen микроорганизмов [20], и псевдоним aeruginosa [21] все получены рекомбинантной подготовки в E. coli. Ферменты все получают путем рекомбинантной подготовки Escherichia coli. Грау -1,3- глюкан моглюб, полученный из магнафора оризае, может быть эффективно выражен системой кишечной палочки. и проявляет противогрибную активность [22].
Хотя прокариотическое выражение в кишечной кишечной киле имеет преимущества быстрого роста и низкой стоимости, некоторые эукариотические гены не могут быть эффективно выражены, поскольку система эукариотического выражения не может распознавать эукариотическую транскрипцию и элементы перевода и не имеет функции последующего преобразования. Таким образом, в последние годы исследователи также широко используют эукариотические экспрессионные системы для выражения β-1,3- глюканазы, такие как Pichia is и Bacillus subtilis экспрессионные системы [23]. Во время процесса промышленного самовыражения пичиа пасторис количество белка, выделяемого самим собой, относительно невелико, поэтому количество белка, выделяемого в качестве целевого, относительно велико.
Однако, поскольку некоторые β 1,3-glucan оказывают гидролитическое воздействие на стенки дрожжевых элементов, их применимость должна быть дополнительно проверена экспериментальным путем. Гетерогенная технология рекомбинантного выражения в настоящее время стала важным методом исследований и подготовки приложений β 1,3-glucan. В то же время сочетание структурной биологии, молекулярной биологии, направленной эволюции и других методов исследований для молекулярного изменения гравитационного -1,3- глюканного излучения, полученного путем гетерологической рекомбинации, может способствовать дальнейшему повышению каталитической эффективности и прикладной ценности фермента. Фэн цзяньвэй и др. [24] обнаружили термофильный грау -1,3- глюкан из компоста. В результате мутагенеза 160 аминокислот были изменены с лизина на глутамическую кислоту, что повысило активность фермента на 1 7%. Мухаммед и др. [25] использовали программы modeller и I-TASSER для выполнения гомологического моделирования 1,3- глюка из дрочжевых Wickerhamomyces normus NCYC 434. Впоследствии термостабильность модели была повышена с помощью средств SPDBViewer и автоматической отключения звука. Было установлено, что мутант E186R обладает наилучшей термостойкостью, а температура плавления увеличена на 9,58 к.
3 структура и каталитический механизм эндо1,3- глюкан
3.1 Endo- 1,3- глюкан
Endo-β-1,3-glucan, также известный как kombu полисахаридный фермент, может специально гидролизировать и резать β-1,3- гликосидические облигации произвольно из внутренней части β-1,3-glucan цепи, производя олигосахариды различной длины. Сообщалось, что эндо -β 1,3- глюканазы в основном распространены в четырех семьях гх GH16, GH17, GH64 и GH81. На сегодняшний день структура и каталитический механизм endo-β- 1,3глюканазов из шести семейств G- г,GH16, GH17, GH64, GH81, GH128 и GH158 были урегулированы. Было получено мало сообщений о структуре эндо-грау -1,3- глюканазы из г55, г152 и г157, и их подробные каталитические механизмы еще предстоит уточнить.
3.1.1 GH16 family endo-β-1,3-glucan
All GH16 family β-1,3-glucanСообщается, что эндотипные, широко распространены в бактериях, грибах и архаях, с преобладание бактериальных источников. Третичная структура г16 семейство грау -1,3- глюканазы богаты грационными складками. Эти цепи изогнуты и сложены на две обратные параллельные ламельные конструкции лицом к лицу, образуя длинный и узкий каталитический канав для связывания длинноцепных субстратов. Трехмерная структура GH16 family β 1,3-glucanase в целом представляет собой структуру бутерброда, также известную как сэндвич-структура (рисунок 3). Fibriansa В то же времяal. [26] сообщили в 2007 году о структуре эндодействующего GH16 family β 1,3-glucanase (BglF), полученной из Nocardiopsis sp. Семейная модель GH16 β 1,3- глюканазы следуют типичному замкнутому механизму гидролиза, при этом во время реакции образуются неустойчивые ферментно-субстратные промежуточные вещества [27].
Субстратная специфика семейства GH16 β-1,3-glucan непосредственно связана с каталитической структурой канава, и они имеют различные гидролитические способности для различных субстратов. Например, грау -1,3- глюканаза зглама из морской бактерии Zobellia galactanβ ans имеет почти в 22 раза более высокую каталитическую эффективность для кельпического полисахаридного субструата (ламинарин), чем для смешанного глюкана (мл г) (грау -1,3- 1,4- глюкан) почти в 22 раза. Это объясняется тем, что каталитический центр згламы имеет конформацию вогнутого отверстия, которая способствует связыванию спирали β 1,3-glucan, а не линейной β 1,3-1,4-glucan (рис. 3B).

3.1.2 GH17 семейная эндотип β 1,3-glucan
The GH17 family β-1,3-glucan includes both endo-type and exo-type, and most of them are endo-type, mainly derived from plants. At present, the GH17 family β-1,3-glucanase with a solved structure is all endo-type. GH17 family proteins have a typical (β/α) 8 TIС. О.(triose-phosphate isomerase) barrel structure (Figure 4), formed by 8 α-helices and 8 β-folds, which form a long and narrow catalytic groove on the surface of the entire enzyme that can accommodate long-chain substrates and run through. The β-chains in the core region of the barrel structure are highly conserved, and the main differences occur in the loop structures and helical structures on the periphery of the protein. GH17 family endo-β-1,3-glucanases, similar to GH16 family, follow a typical conserved hydrolysis reaction mechanism, and an unstable enzyme-glycoside intermediate is formed during the reaction.
Войтковиак и др. [35] получили кристаллическую структуру со-кристалла картофельного эндо -β-1,3-glucan (GLUB20-2) мутанта E259A и fucoidan (рис. 4B), которая является первой сложной кристаллической структурой семейства GH17 гликозидазе и молекулы олигосакчарида, полученной исследователями. Несмотря на то, что активный участок был мутирован, глюб20-2e259a все еще имел остаточную активность. Масс-спектрометрический анализ показал, что мутант разрезал гексозу фукоидан двумя способами, создав две фокусные молекулы трисаксарида или одну фокусную молекулу тетрасаксарида и одну фокусную дисаксаридикулу. Каталитический канав глюб20 -2 образует похожею на каньон геометрию с открытыми концами и изогнутой серединой, которая исключает возможность линейных субstrates, таких как β-1,4-glucan привязки к связующему участку. Это указывает на то, что геометрия активного расщепления участка определяет субstrate специфичность фермента.
3.1.3 GH64 family endo-β-1,3- глюкан
В настоящее время все семейные белки GH64, о которых сообщается, эндотип β-1,3- глюканазы, в основном получены из бактерий. GH64 семейная эндотип -1,3- глюканазы также известны как фукопентаоз-тип -1,3- глюканазы. Они характеризуются катализатором гидролиза грау -1,3- глюкан для производства главным образом фукопентаозы в качестве гидролиза. Семейством GH64 endo-β 1,3-glucanases используется типичный инвертазный каталитический механизм, при котором остатки аспартической кислоты вблизи каталитического центра выступают в качестве широкой основы, а остатки глютамической кислоты-в качестве кислот широкой основы для участия в реакции гидролиза. У и др. [39] получили семейство GH64 β 1,3-glucanase (LPHase) от Streptomyces matensis. LPHase состоит из двух доменов: C-terminal-это домен α/β structure, состоящий из α-helix и β-fold, а N-terminal-это домен, состоящий из двух наборов параллельных дуговых складков. Эти две области образуют u-образный каталитический канав (рис. 5).
Qin Zhen В то же времяal. [40] сообщили о режиме связывания семейства GH64 β 1,3-glucanase (PbBgl64A) от Paenibacillus barengoltzii с комбу гептаузи, в котором две цепи oligosaccharide образуют спираль и связывают с каталитическим канавом PbBgl64A одновременно (рис. 5- B,C). Конформация этих двух цепей почти идентична конформации тройной спирали в тройной спирали β 1,3-glucan. Это говорит о Том, что β 1,3-glucan может быть непосредственно связан в виде тройной спирали в каталитической канаве GH64 семейства endo-β 1,3-glucanase. Режим привязки GH64 family β-1,3- глюканазыtriple-helix β-1,3-glucan substrate is related to the plant disease process. The binding mode of the antifungal sweВ то же времяprotein to the β-1,3-glucan helical sugar chain is similar, indicating a novel binding mode of glycoside hydrolases directly binding to the substrate of the polysaccharide four-fold structure [41-42].
3.1.4 GH81 family endo-β-1,3- глюкан
Семейная белка GH81 широко распространена в бактериях, грибах, растениях и архаях, и все они эндо -1,3- глюкан. До сих пор кристаллические конструкции трех GH81 семейства β 1,3-glucan были решены: BhGH81 из Bacillus halodurans, CtLam81A из Clostridium thermocellum [43] и RmL am81A[44]. Энд-тип GH81 β-1,3- глюканаза состоит из трех структурных областей. Домен N-terminal имеет слогослойную структуру сэндвичей и содержит два комплекта антипараллельных слогослойных листов. Домен C-terminal имеет типичную (α/α) 6- баррельную структуру. Небольшой структурный домен между n-терминалом и c-терминалом состоит из двух противоположных друг другу слоёв и двух слоёв. Все три структурные области образуют длинный, узкий вертикальный каталитический канав (рис. 6).
Ma Junwen В то же времяal. [45] сообщили о семействе GH81 β 1,3-glucan (RmLam81A) из Rhizomucor miehei и показали его субструйный механизм распознавания и каталитический механизм. Исследования показали, что RmLam81A может связывать тройную спираль грава -1,3- глюкана и следовать типичному ретроградальному гидролизу, который обычно достигается в Один этап. Сохраняемый асpartic кислотный остаток каталитического центра действует в качестве общей кислоты для протонирования атома кислорода на гликосидической связи, в то время как глютамическая кислотная кислота действует в качестве общей основы для ее депротонирования, нарушая тем самым гликосидическую связь и завершив процесс гидролиза. Плувинаж и др. [46] сообщили о наличии семейства GH81 β 1,3-glucanase (BhGH81), полученного из галоболератной бактерии Bacillus halodurans. Мутация Glu542 в Gln или Asp466 в Asn полностью нейтрализует BhGH8, что указывает на то, что Glu542 и Asp466 являются его основными каталитическими остатками. Кроме того, сложная структура фермента с полисахаридной цепью указывает на то, что он может связывать по крайней мере две отдельные цепи β 1,3-glucan (рис. 6B), что означает, что фермент может быть в состоянии непосредственно связать к тройной спирали β 1,3-glucan (рис. 6C).
3.2 Exo- 1,3- глюкан
Exo-β-1,3-glucanase гидролиз β-1,3-glucan путем клея β-1,3-glycosidic облигации в конце цепей, последовательно, чтобы производить глюкозу или однократные олигосахариды. Установлено, что exo-тип β 1,3- глюканазы подразделяются на шесть семей гх: г3, г5, г17, г55, г128 и г132, большинство из которых принадлежат к семьям г55 и г5. Кристаллические конструкции экзо-действующих грау -1,3- глюканазов из семей GH5, GH55 и GH128 были решены, в то время как конструкции из семей GH3, GH17 и GH132 были решены редко.
Семейство GH55 β 1,3- глюканазы в основном получают из бактерий и грибов, и большинство из них экзо-действия. Семейные белки GH55 имеют две параллельные правые области между ног и спирали, которые образуют структуру, аналогичную ребрам грудной клетки. Концы N-terminal и C-terminal имеют по 7 и 10 катушек, состоящих из правых поперечных спиральных областей, связанных, соответственно, сегментом аминокислотных остатков. Остаточный элемент состоит из двух параллельных ступеней, а каталитический элемент находится между этими двумя областями (рис. 7а). Бианчетти и др. [47] пришли к выводу, что структура субстратного комплекса exo-type β 1,3- глюканазы (sacteLam55A), полученные из Streptomyces (Setreptomyces sp.), показывает, что GH55 семейства exo-type β 1,3- глюканазы имеют карманный каталитический канав с шестью гликозидными связующими узлами, который может последовательно отрезать моносакшариды глюкозы от неснижающегося конца сахарной цепи (рис. 7 B). Компания general acid сначала передает протон субстратегу#39; гетероатом углерода, в то время как общая база удаляет протон из молекулы воды, повышая его нуклеофиличность и способствуя его атаке на центр гетероатома, тем самым нарушая гликосидическую связь и производя гидролитический продукт. Papageorgiou И др.[48] обнаружили грау -1,3- глюканазу (CtLam55), полученную из термофила гетомия, и установили, что глю654 является одним из ключевых каталитических остатков благодаря структурному сопоставлению и мутагенезу, направляемому на место.
3.3 GH128 family β 1,3-glucan
В последние годы были обнаружены некоторые новые β 1,3- глюканазы, которые в базе данных CAZy классифицированы как GH128 семейства. GH128 family β 1,3-glucanases относятся к суперсемейству gha и имеют углеродно-связывающую область и (α/β) 8- ствольную структуру [49]. Структура ствола самая короткая среди всех известных семейств GH128, в среднем всего 240 аминокислотных остатков [50]. Это семейство включает в себя как эндо-и экзо-действия β-1,3- глюканазы.
Сантос и др. [50] использовали группирование последовательностей сети сходства для разделения семейства GH128 на семь подгрупп и анализировали режим привязки субстратов каждой подгруппы. Они обнаружили, что режим связывания субструтов семейства GH128 β 1,3- глюканазы тесно связан с гидрофобными взаимодействиями и что между семью подгруппами сахарные цепи связывают фермент двумя различными способами: "изогнутыми" и "плоскими" [50]. Кроме того, семейство GH128 β 1,3-glucanase в третьем подсемействе также может быть непосредственно связано с тройной спиралью β 1,3-glucan chain.
3.4 другое семейство: 1,3- глюкан
В дополнение к типичным опор -1,3- глюканазы вышеупомянутых семей, небольшое число экзодействующих опор -1,3- глюканазы с типичной (опор -1) структурой бочек тима 8 было также обнаружено в семьях оп - 3 и оп - 5, и все они следуют сохраняемому каталитическому механизму. Семейство GH132 β 1,3-glucanase известно как солнечный белок и было обнаружено в филятивных грибах и дрожжах [51]. Было получено мало сообщений о семейных белках GH132, и их структуры белков и каталитические механизмы пока не ясны. GH158 family β 1,3-glucanase принадлежит к g-a superfamily. До настоящего времени сообщалось лишь об одном структурном анализе GH158 family β 1,3-glucanase. Dejean et al. [52] получили GH158 family β 1,3- глюканазу (BuGH158) от Bacteroides единообразно, которая состоит из N-terminal (β/α) 8 TIM barrel domain и C-terminal иммунный глобулин (Ig)-like domain. Кроме того, фермент обладает высокой гидролитической активностью по отношению к имеющимся полисахаридам и полисахаридам кельпа.
4 применения 1,3- глюкан
4.1.1. 3- глюкан в противогрибковых приложениях
The decay and deterioration of fruits and vegetables during postharvest transportation, storage and marketing is an important factor affecting the quality, shelf life and safety of human consumption. Decay caused by plant pathogenic fungi is the main cause of postharvest losses of fruits and vegetables. Fungi are eukaryotic organisms, and the cell wall is essential for the survival of fungal cells. Degradation of the cell wall can cause the fungal cells to lose their osmotic pressure balance, so destroying the integrity of the cell wall has become a potential antifungal measure. β-1,3-glucan is an important antibacterial protein secreted by biocontrol microorganisms, and plants themselves also induce the production of β-1,3-glucanase during the process of resisting fungal infection [53].
β-1,3- глюканаза может разлагать β-1,3- глюкановые сахарные цепи в клеточной стенке, что приводит к разрыву или деформации мицелии патогенных грибов, что приводит к утечке протоплазмы патогенных грибов и препятствует споровому прорастанию. Кроме того, этот процесс может также приводить к высвобождению возбудителей осколков стенки грибковых клеток, вызывать иммунную индукцию растений и косвенно способствовать накоплению фитоалексинов в принимающем растении, повышая его устойчивость к болезням [54]. Биологический метод контроля, основанный на 1,3- глюканазе, может эффективно предотвращать и контролировать грибковые заболевания растений. Она обладает такими преимуществами, как отсутствие лекарственной устойчивости, ориентирование только на целевые патогены без нанесения ущерба другим полезным организмам, отсутствие остатков пестицидов и отсутствие токсичности или загрязнения. Поэтому изучение роли β 1,3- глюканазы в послеспективном сохранении фруктов и овощей и разработка новых зеленых биологических консервантов на основе β 1,3- глюканазы является одной из потенциальных тенденций развития технологий зеленой консервации фруктов и овощей.
Лу шубао и др. [55] определили активность β 1,3- глюканазы в листьях сои и ее антибактериальное воздействие на грибы. Результаты показали, что активность грава -1,3 глюканазы на заводе достигла пика через 48 часов после прививки фитофорой содже. Антибактериальный эксперимент был проведен с использованием сырого экстракта фермента β 1,3-glucanase, извлеченного через 48 часов после прививки. Было установлено, что β 1,3 - глюканаз сырого фермента раствор оказывает значительное ингибиторное воздействие на рост мицелии и споровое прорастание фитофтора соджае. Чэнь сяоюн и др. [56] показали, что β 1,3- глюканаза оказывает значительное влияние на сдерживание роста бактерий и заболеваний в фруктах, таких как яблоки, груши и бананы после сбора урожая, и может эффективно предотвращать послеуборочную гниль, вызванное грибами. Эта характеристика может использоваться для хранения и сохранения тропических фруктов. Rajninec et al. [57] обнаружили, что сырой белок β 1,3- глюканазы из дросера бината оказывает ингибиторное воздействие на рост ризоктонии солани, альтернарии солани и фузариум поае.
4.2. 1. 3- глюканный препарат функциональный олигосахариды
β-1,3-glucan, also known as fucoidan oligosaccharides, is a food functional factor with good biological activity, and has the activity of regulating the body's иммунитет, сопротивление инфекции, и регулирование баланса кишечной флоры. Бета -1,3- глюканские олигосахариды, подготовленные гидролизирующими имеющимися полисахаридами или полисахаридами келпа, могут быть использованы в качестве нового типа пребиотических при функциональном развитии пищевых продуктов. Кроме того, некоторые растворимые в малых молекулах бета -1,3- олигосахариды могут использоваться в качестве иммунных активаторов для стимулирования иммунной реакции растений и, таким образом, повышения устойчивости растений к болезням. Кроме того, некоторые маломолекулярные растворимые грава -1,3- олигосахариды могут использоваться в качестве иммунных активаторов для стимулирования иммунной реакции растений, тем самым повышая устойчивость растений к болезням. β-1,3-glucanase гидролиз β-1,3-glucan для подготовки β-1,3-oligosaccharides, который имеет преимущества высокой специфичности и мало побочных продуктов. Считается перспективным методом производства олигосахаридов. Ван яньсин и др. [22] обнаружили, что семейство GH55 β 1,3- глюканаза (AcGluA) может гидролизировать полисахариды келпа в серию олигосахаридов олигосахаридов, и высокие дозы олигосахаридов могут вызывать иммунную реакцию у саженцев риса, тем самым обеспечивая устойчивость к взрыву риса. Это свидетельствует о Том, что гидролитические продукты β 1,3- глюканазы оказывают значительное биорегулирующее воздействие и служат определенным ориентиром для применения β 1,3-oligosaccharides.
Li Kuikui et al. [58] cloned and purified a novel β-1,3-glucanase (GcGluE) from Cellulosimicrobium cellulans- да. Анализ субстратной специфичности и гидролитических продуктов показал, что ферменты демонстрируют самую высокую гидролитическую активность на возобновляемых полисахаридах, а основными гидролитическими продуктами являются дизакхариды и трисакхариды. Кроме того, после предварительной обработки гомогенизации эффективность разложения гклей на ксилане увеличится в 7,1 раза, что имеет определенный потенциал применения. Гао минджи и др. [18] получили от триходермы харзианума грау -1,3- глюканазу, а ферментная активность может достигать 198,57 U/ мл после 118 ч ферментации. На основе характеристик данного фермента был разработан метод подготовки многофункциональных олигосахаридов путем ферментного гидролиза тз -1,3- глюкан, что дает тз -1,3- глюканский фермента определенные перспективы применения в промышленном производстве олигосахаридов.

4.3 применение станка -1,3- глюкан в пивоваренной промышленности
Помимо своей важной роли в производстве противогрибковых и олигосахаридов, β-1,3- глюканаза может также использоваться в пивоваренной промышленности. В пивоваренной промышленности ячмень является основным сырьем для производства пива. В процессе производства некоторые микроорганизмы выделяют высокомолекулярно-весовую грау -1,3- глюкан во внеклеточное пространство, что повышает вязкость ферментационной жидкости, вызывая трудности фильтрации. В конечном итоге в пиве могут образовываться флокулентные гели, что приводит к сокращению производства пива и увеличению расходов на пивоварение. Lu Lili et al. [59] пришли к выводу, что если в процессе ферментации добавляется грау -1,3- глюканаза, то содержание глюкана с высоким молекулярным весом может быть значительно уменьшено, тем самым снижая вязкость брота ферментации, достигая цели сливного пива и улучшая процесс фильтрации.
4.4 подготовка протопластов дрожжевых составов: 1,3- глюкан
The main chemical component of the yeast cell wall is β-glucan. One type is the relatively abundant β-1,3-glucan, which forms the skeleton of the yeast cell wall. The other type is the less abundant β-1,6-glucan, which fills the space. The key to preparing yeast protoplasts is to break down the insoluble β-1,3-glucan in the cell wall, so β-1,3-glucanase is an important preparation for protoplasts [60]. Duan Huike et al. [61] used the β-1,3-glucanase produced by the Trichoderma strain LE02 to enzymolyze and solubilize the beer yeast glucan. Macromolecular water-soluble yeast glucan can also be obtained by β-1,3-glucanase enzymolysis technology and ultrafiltration separation technology.
4.5 грау -1,3- глюкан удаляет биологические пленки
Биопленки представляют собой сложные структуры, состоящие из микроорганизмов и их внеклеточных выделений. Основные вредные бактерии в продуктах питания, такие как сальмонелла и псевдодомы aeruginosa производят биопленки, которые могут уменьшить бактериальный эффект широко используемых дезинфицирующих средств и антибиотиков, создавая риск безопасности пищевых продуктов. β-1,3-glucan является важным компонентом биофильма Candida albicans и играет важную роль во внеклеточной матрице биофильма. В отличие от этого, β-1,3- глюканаза оказывает определенное влияние на удаление биофильма и может контролировать порчи бактерий в пищевой промышленности. Нетт и др. [62] пришли к выводу, что лечение кандиды при низких концентрациях грау -1,3- глюканазы значительно усилило воздействие противогрибковых препаратов флюконазол и амфотерицин в на гриб. Митчелл и др. [63] также экспериментально продемонстрировали, что чувствительность противогрибковых препаратов постепенно повышается с гидролизом глюкана -1,3 во внеклеточной матрице, что указывает на то, что грау -1,3 глюканаза оказывает определенное влияние на удаление биологических пленки.
4.6 синергический эффект от 1,3- глюкана и читиназы
Как β-1,3- глюканаза, так и chitinase имеют эффект разложения β-1,3- глюкан и читин, а также пептидогликан в стенке грибковых клеток. Оба фермента обладают широким спектром сопротивления в защите от вредителей и болезней растений, что может сократить использование химических пестицидов и снизить загрязнение окружающей среды. Mauch et al. [64] пришли к выводу, что комбинированное действие читиназы и β 1,3- глюканазы имеет лучший антибактериальный эффект, чем отдельные ферменты, что указывает на то, что оба фермента имеют синергетический эффект, препятствуя росту патогенных бактерий. В работе Cota et al. [65] сделан вывод о Том, что синергический эффект β-1,3- глюканазы и читиназы может существенно противостоять воздействию Alternaria alternata на хранящиеся помидоры. Это показывает, что β-1,3- глюканаза и читиназа оказывают синергическое воздействие на послеуборочную антибактериальную консервацию фруктов и овощей и обладают большей антибактериальной способностью, чем Один штамм, поэтому имеют хорошие перспективы применения.
5. Выводы
Поскольку β-1,3-glucan может конкретно гидролизировать β-1,3-glucan, он имеет важные перспективы применения в области функциональной подготовки олигосахаридов, сохранения фруктов и овощей, биомедицины, и устойчивости растений к болезням. Исследователи уже изучили структуру, функции и применение ряда различных семейно-гравюрных -1,3- глюканазов. В этом контексте основное внимание в последующих исследованиях по 1,3- глюканазам будет уделено способам получения новых 1,3- глюканазам с хорошими свойствами применения и достижения их эффективной подготовки к ферментации.
Однако из-за сложности природных градиентов 1,3- глюканских субстратов каталитическая эффективность существующих градиентов 1,3- глюканских субстратов по-прежнему нуждается в дальнейшем повышении, а ферментативный гидролиз некоторых нерастворимых градиентов 1,3- глюканских субстратов по-прежнему затруднен. Кроме того, исследования по структуре и функциям ферментов являются важной основой для изучения каталитического механизма ферментов, разработки каталитических свойств ферментов и проведения исследований по молекулярной модификации ферментов. С учетом сложности природных грац -1,3- глюкановых субстратов и разнообразия грац -1,3- глюканаз семейств наблюдается тенденция к изучению различий в связующих и каталитических механизмах различных грац -1,3- глюканаз семейств, прояснение механизма признания грац -1,3- глюканазы для сложных молекул глюкана и изучение комбинированной каталитической системы, основанной на грац -1,3- глюканазе, в целях обеспечения эффективного применения грац -1,3- глюканазы. 1,3- глюканаза является тенденцией развития для его эффективного применения.
Ссылка:
[1] кадам с у, тивари б к, о 'доннелл с п. извлечение, структура и биофункциональная деятельность ламинарина из коричневых водорослей [J]. International Journal of - продукты питанияScience and Technology, 2015, 50(1): 24-31. DOI:10.1111/ijfs.12692.
[2] миёши - к, уезу - к, Сакурай к и др. Предложение о новой форме гидрогенного соединения для поддержания тройной спирали кёрдлана [J]. Химия и фармацевтика Биоразнообразие, 2004, 1(6): 916-924. DOI:10.1002/cbdv.200490073.
[3] фу юньбинь, чжао сяомин, ду югуан. Прогресс в исследованиях биологической активности и применения полисахарида кидрамона и его производных [J]. Наука о еде, 2012, 33(7): 315 — 319.
[4] шимидзу дж., цучихаши н., кудо к., и др. Диетическое курдлан увеличивает распространение бифидобактерий в цеке крыс [J]. Биотехнология и биохимия, 2001, 65(2): 466 — 469. DOI:10.1271/bbb.65.466.
[5] ю ё нхуа, сюй фейфей, лин лин и др. Прогресс в исследовании гиполипиэпидемического эффекта оат-ду-глюкан [J]. Журнал клинических и патологических наук, 2022, 42(2): 486-491. DOI:10.3978 / j.issn.2095-6959.2022.02.034.
[6] дэвис г, генриссат б. структуры и механизмы гликозильных гидролазов [дж]. Структура, 1995, 3(9): 853-859. DOI:10.1016/S0969- 2126(01)00220-9.
[7] ILARI. ЯA, FIORILLO A, ANGELACCIO S и др. Кристаллическая структура эндоглюканазы Famil16 из гипертермофильной основы субстрата Признание [J]. Февраль Journal, 2009, 276(4): 1048-1058. DOI:10.1111/ j.1742-4658.2008.06848.x.
[8] юань, чжан х, чжан х и др. Разлагающий GH5 β-1,3- 1,4- глюканаза PpBglu5A для глюкана в Paenibacillus polymyxa KF-1[J]. Биохимия процессов, 2020, 98: 183-192. Дата :10.1016/ j.procbio.2020.08.008.
[9] джаафар н - р, Хоири н. М, исмаил N F и др. Функциональные возможности системы Характеристика и товарная специфика эндо -1,3- глюканазы Из щелокофильной бактерии Bacillus lehensis G1[J]. 1. Фермент И микробных технологий, 2020, 140. : 109625.
[10] ши п, яо г, ян п и др. Клонирование, определение характеристик и противогрибковая активность эндо1,3- грац-д-глюканазы из Streptomyces sp. S27[J]. Прикладная микробиология и биотехнология, 2009, 85(5): 1483 — 1490. DOI:10.1007/s00253-009-2187-1.
[11]HARTL L, GASTEBOIS A,AIMANIANDAV и др. Характеристика закрепленного на гпи эндо β 1,3-glucanase Eng2 Aspergillus fumigatus[J]. Грибковая генетика и биология, 2011, 48(2): 185 — 191. DOI:10.1016/j.fgb.2010.06.011.
[12]DA SILVA AIRES - р,STEINDORFF A - с,RAMADA M H S и др. Биохимическая характеристика 27 кда 1,3- граво-д-глюканаза из триходермаасперелла, вызванная клеточной стенкой ризоктонии солани [J]. Углеводы полимеры, 2012, 87(2): 1219-1223. DOI:10.1016/ j.carbpol.2011.09.001.
[13] ишида т, фушинобу с, каваи р и др. Кристаллическая структура гликозидных гидролаз семейства 55 грау -1,3- глюканазы из басидиомицета Phanerochaetechrysosporium[J]. Журнал биологической химии, 2009, 284(15): 10100-10109.
[14] VARGHESE J N, GARRETT T P, COLMAN P M, et al. Три - - Размерные структуры двух растений: грац-глюканские эндогидролазы с отчетливой субстратной спецификой [J]. Труды национальной академии Науки соединенных штатов америки, 1994, 91(7): 2785-2789.
[15] ромеро - я, Фернандес-кабальеро C, C,C, Гони о, и др. Функциональность класса I β-1,3- глюканаза из кожи столового винограда Ягоды [J]. Наука о растениях, 2008 174(6): 641-648. Дата :10.1016 / j.plantsci.2008.03.019.
[16] YU W Q, ZHENG G P, QIU D. Д.W, et al. Paenibacillus terrae NK3-4: потенциальный агент биоконтроля, который производит β-1,3- глюканазу [J]. Биологический контроль, 2019, 129: 92 — 101. DOI:10.1016/j.biocontrol.2018.09.019.
[17]1. ЛиC, WEN Y, Он и есть... И др. Очистка от загрязнения И определение характеристик Из нового грава -1,3- глюканазы из арка-надута и его иммунитет - Усиление воздействия [J]. Пищевая химия, 2019, 290: 1-9. DOI:10.1016/ j.foodchem.2019.03.131.
[18] гао минджи, ян цзяцзюнь, чжао юэ и др. Выражение своего мнения Термостабильный грау -1,3- глюканазес триходерма харзианум в пичиа пасторис и использование при гидролизе олигоглукозидов [J]. В рамках процесса Биохимия, 2021, 107: 74 — 82.
[19] чжан - д, - привет. - привет. - д, В чем дело? S, et al. Клонирование, характеристика и выражение гена exo-1,3-β-glucanase из антагонистических дрожжей, штамм M8 Pichia guilliermondii штамм против серой плесени на яблоках [J]. Биологический контроль, 2011, 59(2): 284 — 293. Дата :10.1016/j.biocontrol.2011.06.018.
[20] кальяни D C, - райхенбах. Ти, аспеборг H, et Al. Гомодимерная бактериальная exo-β,3- глюканаза, полученная из микробиома мус-rumen, имеет структурную структуру, аналогичную дрожжевой exo-β,3- Глюканазы [J]. Фермент и микробные технологии, 2021, 143: 109723. DOI:10.1016/j.enzmictec.2020.109723.
[21]YI P, YAN Q, JIANG Z, et al. Первая гликозидовая гидролаза семейства 50 endo-β- 1,3d -glucanase из псевдодомы aeruginosa[J]. Фермент и микробные технологии, 2018, 108: 34 — 41. DOI:10.1016/ j.enzmictec.2017.09.002.
[22] ван яньсин, чжао юцян, ван сяоуэн и др. Функциональная характеристика романа ламинарипентаоз-производящий грау -1,3- глюканаз моглуб и его биоконтроль над магнапорте оризае [J]. Журнал сельскохозяйственной и пищевой химии, 2021, 69(33): 9571-9584.
[23] чэн чженсян. Выражение β-1,3- глюканазы в Pichia is [D]. Харбин: харбинский технологический институт, 2013: 5-10.
[24] фэн цзяньвэй, сюй шенюань, фэн руйруи и др. Идентификации и идентификации Структурный анализ термофильной графы -1,3- глюканазы компоста [J]. Биоресурсы и биопереработка, 2021, 8(1): 102 — 112. DOI:10.1186/ s40643- 21-00449-4.
[25] Мухаммед м. т., сын с. д., İ ZGU F. трехмерная структура Предсказание паномикоцина, романа exo-β-1,3- глюканазы, изолированные от аномалий викерхамомициса NCYC 434 и вычислений Исследования мутагенеза под руководством сайта с целью повышения его термоустойчивости для терапевтического применения [J]. Вычислительная биология и химия, 2019, 80: 270 — 2777. Дата :10.1016/j.compbiolchem.2019.04.006.
[26]FIBRIANSAH G, MASUDA S, KOIZUMI N, et al. Кристаллическая структура 1,3 ангстрома романа endo-β-1,3- глюканаза семейства гликозидных гидролаз 16 из alkaliphilic Nocardiopsis sp. деформация F96[J]. Белки, 2007 год,69(3): 683-690.
[27] вуонг Т V, Вильсон д. б. гликозидные гидролазы: каталитическая база/нуклеофильное разнообразие [J]. Биотехнология и биоинженерия, 2010, 107(2): 195 — 205. DOI:10.1002/bit.22838.
[28]ILARI A, FIORILLO A, ANGELACCIO S и др. Кристальная структура семейства 16 эндоглюканазы из гипертермофильной пирококковой фурии-структурной основы распознавания субструатов [J]. The FEBS Journal, 2009, 276(4): 1048-1058. DOI:10.1111/j.1742-4658.2008.06848.x.
[29] ода м, инаба с, камиян и др. Структурная и термодинамическая характеристика эндо1,3- гравитационная глюканаза: анализ механизма распознавания субстратов [J]. Протеомика бба-белки, 2018, 1866(3): 415 — 425.
[30]JENG W Y, WANG N C, LIN C T и др. Кристаллические конструкции здания Laminarinase каталитический домен от Thermotoga maritima MSB8 в комплексе с ингибиторами основных остатков для выбора 1,3 и 1,4 глюканов [J]. Журнал биологической химии, 2011, 286(52): 45030-45040.
[31]HONG T Y, HSIAO YY, MENG M, et al. В настоящее время 1.5 ангстромовая структура эндо1,3- грац-глюканазы от стрептомициес сиояенсис: эволюция активной структуры участка 1,3- грац-глюкано-связывающая специфика и гидролиз [J]. Acta Crystallographica Section D: структурная биология, 2008, 64: 964-970. DOI:10.1107/s0907444908021550.
[32] блихер л, пратс е т, гомиш т с ф и др. Молекулярная основа термостабильности и термофилиальности ламинариназов: рентгеновская структура гипертермостабильной ламинариназы из родотермуса марина и моделирование молекулярной динамики [J]. Журнал физической химии B, 2011, 115(24): 7940-7949. DOI:10.1021/jp200330z.
[33] лабурел а, джем м, Джуди а и др. В результате взрыва в грау-глюканасезгламе из зобелии галактаниарцы сформировался изогнанный активный участок, приспособленный для эффективной деградации ламинаринов водорослей [J]. Журнал биологических исследований Химия, 2014, 289(4): 2027 — 2042.
[34]YANG - джей,XU Y Q, MIYAKAWA T и др. Молекулярная основа для распознавания субстратов и катализа морской бактериальной ламинариназы [J]. Прикладная и экологическая микробиология, 2020, 86(23): 15. DOI:10.1128/aem.01796-20.
[35] войтковик а, витек к, хенниг дж и др. Структуры действующего мутанта завода 1,3- грава-глюканаза в комплексе с олигосахаридами продуктов гидролиза [J]. Acta Crystallographica Section D: биологическая кристаллография, 2013, 69: 52 — 62. DOI:10.1107/s0907444912042175.
[36] реджевер-бречо т - V, Чеж зек (Чешская республика) - м, - барре. A., et Al. Кристаллическая структура с разрешением 1.45 — a основной эндо аллергена — β-1,3- глюканазы банана как молекулярной основы латексового фруктового синдрома [J]. Белки, 2006, 63(1): 235 — 242.
[37] жареные F, BECKER S, ROBB C S и др. Адаптивные механизмы, обеспечивающие конкурентные преимущества морским бактериям во время микроцветения водорослей [J]. ISME Journal, 2018, 12(12): 2894-2906. DOI:10.1038/s41396-018-0243-5.
[38] такасима т, таку т, яманака т и др. Кристаллическая структура и биохимические характеристики CJP38, a β-1,3- глюканазы и аллергена криптомерии японики пыльцы [J]. Молекулярная иммунология, 2019, 116: 199 — 207.
[39]WU H M, LIU S W, HSU M T и др. Структура, механическое действие и основные остатки фермента gh64, производящего ламинарипентаоз: 1,3- глюканаза [J]. Журнал биологической химии, 2009, 284(39): 26708-26715.
[40] цинь чжен, ян Дон, ты син и др. Механизм распознавания тройной спиральной гравюры -1,3- глюкан на гравюру -1,3- глюканазу [J]. Химическая связь, 2017, 53(67): 9368 — 9371. DOI:10.1039/c7cc03330c.
[41] гош - р, 13. Чакрабарти В. : с. - кристалл Структурный анализ NP24-I: тауматинный белок [J]. Планы, 2008, 228(5): 883-890. DOI:10.1007/s00425-008-0790-5.
[42] хенриссат B, - гаррон. M - я. Как это сделать? a Гликозидная гидролаза распознает спиральный полиглюкан [J]. Структура, 2017, 25(9): 1319-1321. Дата :10.1016/j.str.2017.08.004.
[43] кумар к, Коррейя м а с, Пиреш в м - р, et Эл. Роман Анализ разложения 1,3- глюкансби целлюлозы Термоцеллюм клостридия, выявленный в ходе исследований структуры и функций семейства гликозидных гидролаз 81 [J]. < < международный журнал > > Биологических макромолекул, 2018, 117: 890 — 901. DOI:10.1016/ j.ijbiomac.2018.06.003.
[44] чжоу пэн, чэнь чжунчжоу, ян цяохуан и др. Структура гликозидного гидролаза семейства 81 endo-β 1,3-glucanase[J]. Секция D Acta Crystallographica: структурная биология, 2013, 69: 2027-2038. DOI:10.1107/s090744491301799x.
[45] ма юнвен, Цинь чжен, чжоу - пэн, И др. Структурные исследования в области распознавания субстратов и каталитического механизма гидролазы грибкового гликозида семейства 81:1,3- глюканаза [J]. Фермент и микробные технологии, 2022, 153: 109948. [46] Плувинаж б, филло а, массель п, и др. Структурный анализ семейства гликозидных гидролаз 81 предполагает признание им грава -1,3- глюканской четвертичной структуры [J]. Структура, 2017, 25(9): 1348-1359. DOI:10.1016/j.str.2017.06.019.
[47] BIANCHETTI C M, TAKASUKAT - э,DEUTSCH S, et al. Активный участок и ламинарин связывания в гликосайд гидролазе семейства 55[J]. Журнал биологической химии, 2015, 290(19): 11819 — 11832. DOI:10.1074/ JBC. М114.623579.
[48] PAPAGEORGIOU A C, Чэнь (Китай) J, LI D. < < кристалл > > Структура и биологические последствия семейства гликозидных гидролаз 55 грау -1,3- глюканаза из термофила гетомия [J]. Biochimica et biohysica acta-белки и протеомика, 2017, 1865(8): 1030-1038. DOI:10.1016/j.bbapap.2017.05.002.
[49] цзя X, ван C, ду X и др. Специфический гидролиз курдлана с новым гликозидным гидролазом семейства 128 грау -1,3- эндоглюканаза, содержащая углеводно-связывающий модуль [J]. Углеводы полимеры, 2021, 253: 117276-117286.
[50] сантуш к р, коста п, виейра п с и др. Структурные наблюдения за расщеплением β-1,3-glucan со стороны семейства гликозидных гидролаз [J]. Химическая биология природы, 2020, 16(8): 920 — 929. DOI:10.1038/s41589-020- 0554-5.
[51] GASTEBOIS A, AIMANIANDA V, Бачелье-басси С, и др. Солнечные белки принадлежат к новой семье грава -(1,3)- глюкано-модифицирующих ферментов, участвующих в грибковый морфогенез [J]. Журнал биологической химии, 2013, 288(19): 13387-13396.
[52] дижан г, тамура к, кабрера и др. Синергизм между клеточными гликозидазами поверхности и гликанно-связывающими белками диктует необходимость использования конкретных β(1,3)- глюканов бактериальными бактериями кишечника человека [J]. Мбио, 2020, 11(2): 1-21.
[53] янь ф, е х л, ли ч и др. Изоляция, очищение, клонирование генов И выражение антигрибкового белка из бациллуса амилоликефасиенса Мг - 3 [дж]. Food - химия, 2 0 2 1, 3 4 9: 7. Работа. DOI: 10. 1 0 1 6 / j.foodchem.2021.129130.
[54] FESEL P H, ZUCCARO A.β-Glucan: ключевой компонент стенки грибковых клеток и неуловимые растения мампин [J]. Грибковая генетика и биология, 2016, 90: 53 — 60. DOI:10.1016/j.fgb.2015.12.004.
[55] Лу шубао, пэн дунцзюнь, ван хуэй. Бактериальная активность сои β,3- глюканазы [J]. Журнал хайлунцзян байи сельскохозяйственный университет, 2008 (3): 27-29.
[56] чэнь сяоюнь, ли цзяньбинь, лин ин и др. Применение грава -1,3- глюканазы и читиназы в сохранении тропических фруктов [J]. Наука и технологии пищевой промышленности, 2008(5): 294-296.
[57] раджнинец м, фратрикова м, бозорадова е и др. Базовая грау -1,3- глюканаза дросера бината обладает антигрибным потенциалом у трансгенных табачных растений [J]. Заводы, 2021, 10(8): 1747-1762. Дата :10.3390/plants10081747.
[58] ли куйкуй, чэнь вэй, ван вэнься и др. Эффективная деградация порошка курдлана новым эндо -1,3- глюканаза [J]. Углеводы полимеры, 2018, 201: 122 — 130. DOI:10.1016/j.carbpol.2018.08.048.
[59] Lv Lili, Wang Ruibin, Wang Jialin и др. Влияние высокоэффективной градо-глюканазы на скорость фильтрации ворта [J]. Пивоваренная наука и техника, 2010(3): 75 — 77. DOI:10.13746/j.njkj.2010.03.028.
[60] линь кайцзян, руан лихуан, ван лоньинг. Исследования по подготовке протопластов дрожжей с целлюлазой [J]. Бюллетень по науке и технике, 1996 год, 12(2): 118-121.
[61] дуан хуэйке, сюн шанбо, лю хаймей. Ферментативная растворимость дрожжей β-1,3-glucan and product analysis [J]. Наука о еде, 2008, 29(1): 185 — 189.
[62] нетт джей, линкольн л, марчилло к и др. Предполагаемая роль β 1,3 глюканов в сопротивлении biofilm Candida albicans [J]. Противомикробные препараты Химиотерапия, 2007, 51(2): 510-520. DOI:10.1128/ aac.01056-06.
[63] митчелл к ф, тафф х т, куэвас ма и др. Роль матрицы ту -1,3 глюкана в противогрибковой устойчивости неальбиканцев Candida Biofilms[J]. Антимикробные агенты и химиотерапия, 2013, 57(4): 1918 — 1920. DOI:10.1128/aac.02378-12.
[64] MAUCH F, MAUCH- mani B, BOLLER T. антигрибковые гидролазы в тканях гороха: II. Ингибирование роста грибов сочетаниями читиназы и грава -1,3- глюканазы [J]. Физиология растений, 1988, 88(3): 936-942.
[65] кота I E, Тронкосо-рохас - р, Сотело-мундо R, et al. Читиназ и грау -1,3- глюканаза 1. Ферментативная ферма Мероприятия в области развития in Реакция на инфекцию Alternaria alternata оценивается в двух Стадии развития различных разновидностей томатных фруктов [J]. Организация < < сайенс > > - садоводство, 2007, 112(1): 42-50.
-
Предыдущий
Какие виды применения бета-глюканного порошка в кормлении животных?
-
Следующий проект
Каковы методы производства Galacto Oligosaccharide (GOS)?


 Английский язык
Английский язык Французский язык
Французский язык На испанском языке
На испанском языке Русский язык
Русский язык Корейская народно-демократическая республика
Корейская народно-демократическая республика На японском языке
На японском языке




