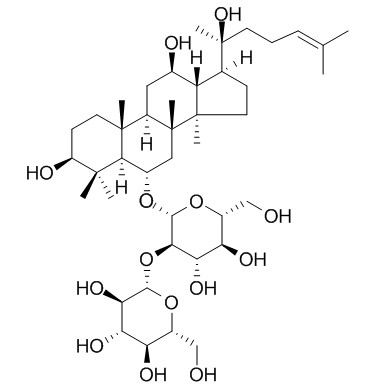
Исследование на различных типах женьшень экстракт женьшень
Ginsenosides (GS) are В настоящее времяmaВ случае необходимостиАктивный образ жизниingredients В случае необходимостиprecious medicinal herbs such По состоянию на 31 декабряginseng, panax notoginseng иAmerican ginseng. They belong to В настоящее времяtriterpenoid glycoside class иare composed Соединенные Штаты америкиA/данные отсутствуют.glycoside (ginsenoside) иa sugar group [1]. Ginsenosides have a wide range Соединенные Штаты америкиБиологического оружия иactivities, such as Борьба с опухолями[2], Противовоспалительные средства[3], anti-fatigue [4-5] иanti-oxidatiПо состоянию на[6], etc., иsecondary ginsenosides exhibit even more excellent activities. However, the highly active secondary ginsenosides have problems such as low content, Бедные слои населенияwater solubility, low bioavailability and short half-life [7], which limits the applicatiПо состоянию наСоединенные Штаты америкиginsenosides in the fields Соединенные Штаты америкиfood health care and biomedicine.
Структурная модификация является важным средством повышения биологической активности женьшеня, улучшения фармакокинетических свойств и снижения токсичности. Женьшень, как правило, состоит из гидрофобного агликона, связанного с 1-4 гидрофильных сахарных моет, так что они могут быть изменены этими двумя способами. В настоящее время изменение женьшеня в основном принимает стратегии химической модификации, а производные женьшеня с лучшей активностью и физико-химическими свойствами получают путем изменения структуры агликоня или изменения сахарной цепи [8]. С точки зрения структуры, циклоалкановая структура aglycone стабильна, и трудно напрямую изменить хребет aglycone.
В нынешних основных стратегиях модификации основное внимание уделяется гидроксильной группе агликонуса, а производные с различными структурами получают с помощью синтетических методов, таких, как эстерификация, окисление, введение гетероциклических циклов или молекулярная гибридизация. Изменения в сахарной цепи связаны главным образом с распространением сахарной благочестия или модификацией гидроксильной группы в сахарной цепи. Исследования показали, что тип, количество и место привязки сахарной группы к материнскому ядру женьшеня тесно связаны с биологической активностью женьшеня [18-20]. В целом, соотношение между количеством групп сахара и антиопухолевой активности женьшеня является следующим: агликоне > Моносакварид гликозид > Disaccharide glycoside > Trisaccharide glycoside > Тетрасаксарид гликосайд. Поэтому изменение сахарных цепей женьшеня имеет большое значение для улучшения их биологической активности. В настоящем документе рассматривается достигнутый в последнее время прогресс в области химической модификации и биологической деятельности женьшеня, разъясняется взаимосвязь между структурой и активностью и резюмируются характеристики и законы структурной модификации женьшеня, что служит основой для последующей структурной модификации.
1 классификация и структурные характеристики женьшеня
В соответствии с различными структурами aglycone, они могут быть разделены на три типа: dammarane типа, oleanane типа и ocotillol типа. Женьшень dammarane-типа женьшень может быть далее подразделяется на протоанаксиол (PPD) и propanaxatriol (PPT) в соответствии с положением замещающей группы, прикрепленной к aglycone.
1.1 тип Dammarane
Dammarane-type ginsenosides include PPD and protopanaxatriol (PPT), which are tricyclic triterpene saponins. CommПо состоянию наprotopanaxadiol ginsenosides include C-K (1), Класс r2(2), Rd (3), Rg3 (4), Rb1 (5), Ra1, Ra2, Ra3, Rb2 and panaxadiol (PD) (Fig. 1). Since ginsenosides 1, 2, 4 and 5 have stronger biological activity, С их стороныIi. Обобщениеand modification have attracted much attention [9-11]. Common protopanaxatriol-type ginsenosides mainly include Rh1 (6), Rg1 (7), Rg2 (8), Re, Rf, F1, F3, F5 and glycosylated panaxatriol (PT) (see Figure 2), among which 6, 7 and 8 have been studied extensively [8, 12].
1.2 тип оланолиевой кислоты
Женьшень оланолиевой кислоты представляют собой пентациклические тритепеньские сапонины, образующиеся путем гликозилирования оланановых сапонинов (оов) на позициях с -3 и с -28. Женьшень обыкновенного оланолического кислотного типа включает, в частности, R3 (9), Ro (10) и R4 (11) [13-14] (см. рис. 3).
1.3 типы окотиллола
Типсапогины окотиллола (орешки) могут образовывать четыре формы соответствия: (20 - е, 24 - е), (20 - е, 24 - е), (20 - е, 24 - е) и (20 - е, 24 - е) в зависимости от конфигурации связанных между собой сахарных соединений с -20 и с -24. Широко распространенная женьшень окситропа включает F11 (12), RT5 (13), RT2 (14) и т.д. [15-17] (см. рис. 4).
2 структурная модификация женьшеня и отношения < < структура-активность > >
2.1 модификация эстерификации
Женьшень характеризуется низкой растворимостью в воде и низкой растворимостью в жирах, что приводит к низкой биодоступности и неэффективному поддержанию здоровья и терапевтическому воздействию. Идеальная липофильность молекулы препарата должна находиться в определенном диапазоне для обеспечения ее биодоступности и клинической эффективности [8]. Фармакокинетические исследования показали, что женьшень гидролизируется кишечной флорой после перорального введения, а метаболиты, образующиеся в результате гидролиза, поглощаются в печень через вену, где они реагируют жирными кислотами, образуя жирные эфирные соединения [21]. Дальнейшие исследования показали, что производные женьшеня, связанные с жирными кислотами, имеют низкую цитотоксичность в клетках, длительное время проживания и более длительный эффект. С другой стороны, поскольку клеточные мембраны в основном состоят из липидов, производные липофильных эфиров могут способствовать оральному усвоению нежелательных лекарств путем улучшения общей проницаемости мембран. Эти выводы дают идеи для изменения женьшень. Модификация женьшеня с использованием таких кислот, как органические кислоты (жирные кислоты, ароматические кислоты, ангидриды), аминокислоты и неорганические кислоты (серная кислота) является важной стратегией для изучения женьшеновых производных.
2.1.1 изменение содержания органических кислот
Liang В то же время- эл. - привет.reacted the hydroxyl group at the C-3 position Соединенные Штаты америкиЖеньшень Rh2 (20S-Rh2, 2) with two 6-maleimidocaproic acid and 11-maleimidoundecanoic acid Производные финансовые инструментыwith hydrophilic functional groups and different carbon chain lengths to obtain the esterified Производные финансовые инструменты15 and 16 (see Figure 5). Compared with Rh2, the solubility Постоянный представитель российской федерацииtwo modified products increased По запросу:about 4 times and 2 times, respectively. In vitro anti-proliferation Деятельность организации объединенных нацийtests showed that compound 15, which has a shorter carbon chain, exhibited higher Ингибиторий (ингибиторий)activity against the HeLa cell line, while compound 16, which has a longer carbon chain, did not show anti-proliferative activity [22]. Li В то же время- эл. - привет.reacted decanoic acid, cyclohexanecarboxylic acid and isobutyric acid reacted with the C-20 hydroxyl group Соединенные Штаты америкиginsenoside C-K to synthesize three ginsenoside C-K monoesterified derivatives (17–19) [23] (see Figure 5).
Что касается ингибирования роста линии клеток рака молочной железы MCF-7, то ингибиторная активность соединений 18 и 19 при 25 μmol/L была значительно выше, чем у женьшеня к-к, в то время как соединение 17 не показало никакого ингибиторного эффекта, что указывает на то, что производные женьшеня, модифицированные короткоцепными жирными кислотами, имеют более высокую антиопухолевую активность, чем те, модифицированные длинноцепными жирными кислотами. Другие исследования [24-27] также показали, что измененияshort-chain fatty acid saponin derivatives not only have optimized physicochemical properties, but also have better anti-tumor Последствия для окружающей средыthan long-chain fatty acid esters.
Ли и др. синтезировали полностью ацетилированный производный женьшеня к-к путем полиэфиризации модификации, за исключением гидроксиловой группы с -6 на основе глюкозы [28] (см. рис. 5). Тесты на антиопухолевую активность показали, что по сравнению с с-к, он может препятствовать распространению нескольких линий опухолевых клеток при более низких концентрациях, в то время как значительно замедляют рост опухоли в гепатоклеточной карциномой ксенотрансплантационной модели без побочных эффектов на основные органы.
Можно видеть, что после эстерификации модификации женьшеня к-к, его цитотоксичность снижается и его антиопухолевая активность увеличивается. Ван и др. отреагировали гидроксиловой группой дп C-3 производными бензоиновых кислот, аминокислотами и тетрахлорфтальным ангидридом, чтобы получить ряд производных дп 21-31 [29] (см. рис. 5). Тесты по борьбе с распространением опухолей показали, что большинство соединений оказывают ингибиторное воздействие на линии раковых клеток, включая клетки рака печени человека, клетки рака легких A549, клетки рака груди человека MCF-7 и клетки рака толстой кишки человека HCT-116. По сравнению с P- д,производные женьшеня 22, 23 и 26 продемонстрировали значительное ингибиторное воздействие на распространение раковых клеток. Например, 22 имели наименьшее значение IC50 для A549 (IC50 = 18,91 ± 1,03 μmol/L), в то время как для клеток MCF-7 соединение 23 демонстрировало лучшую ингибиторную активность (IC50 = 8,62 ± 0,23 μmol/L). Этот результат показывает, что введение ароматической кислоты в женьшень также может значительно улучшить антиопухолевую активность.
Вышеупомянутая взаимосвязь между структурой и активностью показывает, что внедрение короткоцепных жирных кислот в женьшень демонстрирует лучшую активность, чем длинноцепные жирные кислоты. Количество модифицированных участков эстерификации (моноэфиры и полиэфиры) и тип кислоты (жирные кислоты и ароматические кислоты) не оказывают существенного воздействия на биологическую активность.
2.1.2 модификация аминокислот
25- гидроксил-протопанаксиол (25-OH-PPD) (34), естественное соединение, изолированное от плодов женьшеня, имеет значительную антиопухолевую активность и преимущества низких побочных эффектов и высокой абсолютной пероральной биодоступности. Юань и др. [30] в сочетании с небелковыми аминокислотами, которые играют уникальные физиологические функции и медицинские ценности, разработали и синтезировали ряд новых 25- о-пп производных 33-45 (см. рис. 6). Например, соединение 33 показало сильную антиопухолевую активность по отношению к клеткам HCT116 и BGC-823, значения IC50 составили 4,76 μmol/L и 6,38 μmol/- L,соответственно (см. таблицу 1).
Как видно из таблицы 1, значения ик50 для некоторых модифицированных продуктов, не содержащих белков аминокислот, превышают 100 μmol/L, в то время как антиопухолевая активность модифицированных продуктов, содержащих белки аминокислот, как правило, лучше, чем у модифицированных продуктов, не содержащих белки аминокислот, и все их значения ик50 ниже 30 μmol/L. С другой стороны, аминокислоты на женьшеновых производных с IC50 значение менее 10 μmol/L для анти-опухолевого распространения все имеют бобовые защитные группы, и удаление бобовых защитных групп значительно снижает антиопухолевую активность продукта, что косвенно указывает на то, что повышение растворимости липидов продукта через эстерификацию может значительно увеличить биологическую активность женьшеновых производных.
2.1.3 изменение содержания неорганических кислот
At present, inorganic acid modification mainly uses the sulfonating re- агент агент.chlorosulfonic acid to react with the hydroxyl groups on the ginsenoside sugar chain to form a sulfonate, which is then converted to a salt by neutralization with pyridine. As the introduction Соединенные Штаты америкиa sulfate group increases the polarity Постоянный представитель российской федерацииginsenoside derivative, solubility is improved. It has been reported that the anticancer activity of sea cucumber saponins, which have a similar structure to ginsenosides, is related to the sulfate group,the fewer sulfate groups present on the sugar chain, the stronger the Борьба с ракомactivity [32].
Based on these findings, Guo В то же время- эл. - привет.[33] used the chlorosulfonic acid-pyridine method to sulfate modify ginsenosides. The resulting derivative SMTG-d3 enhanced По окружающей средеkiller cell activity by promoting the proliferation of T lymphocytes and the production of IFN-γ and TNF-α cytokines. Compared with ginsenoside, SMTG-d3 not only reduces cytotoxicity, but also further enhances antitumor immune activity. Previously, Fu В то же время- эл. - привет.[34-36] also used this method to convert the C-6 hydroxyl group Из 20(S) женьшеньКласс r2to a sulfonate ester and В обобщенном видеtwo new derivatives 60 and 61 with greatly improved solubility (see Figure 7). Further studies have found that both derivatives can enhance Противовоспалительные средстваand immune Последствия для окружающей средыby blocking mitogen-activated protein kinase and the Выход на свободуof pro-inflammatory mediators По желанию пользователяby activation. This shows that the sulfation of ginsenoside derivatives can increase their solubility, thereby enhancing Мероприятия в области развитияsuch as anti-inflammatory and anti-tumor effects.
2.2 окислительная модификация
Планары двойной связи на женьшень боковой цепи и гидроксил группы в структуре агликоня обеспечивают реакции участков для изменения окисления, что позволяет окисление с -17 боковой цепи и а и с кольца некоторых женьшень. Исследования показали, что двойная связь на женьшеньовой стороне цепочки является одной из причин ее низкой растворимости [37]. Женьшень может повысить их растворимость в воде путем снижения степени ненасыщения или добавления ионизируемых групп, таких как карбоксильные группы путем окислительной модификации, тем самым повышая их биологическую активность.
Wong В то же время- эл. - привет.[38] окислили двойную связь на боковой цепи ginsenoside 20(R)-Rh2 (2), чтобы получить производную 20(R)-Rh2E2 (62), которая может эффективно предотвратить развитие колоректального рака, вызванного окисленным азометаном /dextran сульфат соли натрия (AOM/DSS) (см. рис. 8). Например, ик50 для клеток рака легких (LLC-1) составляет 56 μmol/L.
Установлено, что PPD метаболизируется в печени человека, образуя эпоксид с -20-24, который содержит костяк пиксинола и обладает хорошей противовоспалительной активностью [39]. Ван и др. эпоксидированные 20(S)-PPD, а затем подвергнутые окислению DSS-martin, селективному сокращению с помощью набн4, конденсации и дезащиты реакции для получения серии аминокислотных модифицированных C-12 окисленных пиксиноловых производных [40] (см. рис. 9). Цитотоксичные испытания In vitro показали, что большинство производных не оказывают значительного токсического воздействия.
Using the Griess method to test the inhibitory activity of these derivatives on nitric oxide in RAW264.7 macrophages, derivatives 63a, 63b, 63c, 63d, 64e, 66b, and 66c showed good anti-inflammatory activity (inhibition rates of 48% to 85%), even better than Y13 (known as the Pyxinol derivative with the best anti-inflammatory activity at the C-12 site, with a hydroxyl group, and an inhibition rate of <40%) and the clinically approved glucocorticoid steroid drug hydrocortisone sodium succinate. A/данные отсутствуют.structure-activity relationship study showed that oxidation of Pyxinol at the C-12 position can effectively improve the anti-inflammatory activity of derivatives modified at the C-3 position. In particular, N-Boc-protected aromatic amino acids can significantly enhance their anti-inflammatory activity. At the same time, derivatives with the absolute configuration of R at the C-24 position are more active.
Ван и др. [41] использовали аналогичный метод выборочной окисления положения C-3 пиксинола скелета кольцо и одновременно ввести Майкл акцептор для подготовки 24 новых женьшеновых производных (67a-67h, 68a-68h, 69a-69h) (см. рис. 10). Соотношение «структура-активность» показывает, что слияние женьшеносистой части PPD с майклом акцептором может усилить противовоспалительную активность производного, а присутствие группы по удалению электронов на майкле акцепторе дополнительно усиливает противовоспалительную активность. Противовоспалительная активность производного, полученная путем изменения положения C-20 PPD с тетрагидрофуранским кольцом, была значительно снижена, однако противовоспалительная активность производного, в котором кольцо окислено, практически не была нарушена, что далее указывает на то, что противовоспалительная биологическая активность некоторых женьшеновидных сторон может быть значительно улучшена путем изменения окисления.
14. Чжан и др. [42] гидролизировали PD и окислили его с использованием пиридинехлоромата (PCC), O2 и H2O2 для получения ряда боковых цепочек C-17 и производных кольцевого окисления a и C (см. рис. 11). Тесты на антиопухолевые клетки показали, что некоторые соединения демонстрируют лучшую антираспространенческую активность, чем положительный контроль на шести клеточных линиях, включая а549 (Рак легких человека), 8901 (Рак яичников человека) и другие клеточные линии. Например, в клеточной линии U87 (глиома человека) соединения 70, 78, 82 и 83 были более эффективными, чем позитивный контроль, при этом соединение 82 имело IC50 19,51 ± 1,00 μmol/L. В клеточной линии MCF-7 (Рак молочной железы человека), по сравнению с 5- флюрорацильным и PD, соединения 71 и 82 продемонстрировали лучшую противоопухолевую активность (IC50 = 17,73 ~ 23,58 μmol/L); Соединения 71 и 74 также продемонстрировали хорошую антипролиферативную активность в клетках хела. Исследования показали, что внедрение структуры энола на деривативе кольца деривативов PD может улучшить их антиопухолевую активность, но не все окислительные модификации деривативов PD достигают этого эффекта. Например, уменьшилась антипролиферативная активность соединения 81, которая была получена путем дальнейшего окисления H2O2.
2.3 гетероциклическая модификация
Гетероциклические соединения часто используются при разработке и синтезе лекарственных средств из-за их структурного разнообразия и широкого спектра биологических видов деятельности, что обеспечивает расширение имеющегося пространства для химии, подобной наркотической. Большинство продаваемых на рынке наркотиков содержат гетероциклические структуры, при этом гетероциклы азота являются наиболее распространенными в продаваемых на рынке структурах наркотиков. Гетероциклы азота и кислорода, обычно встречающиеся в молекулах лекарственных средств, содержат одинокие пары электронов, которые могут образовать водородные связи, что способствует повышению растворимости в воде и, следовательно, биодоступности. Пиперазиновые кольца и пиперидные кольца являются весьма распространенными азотными гетероциклическими структурами в продаваемых на рынке лекарственных средствах. Они могут быть дополнительно переработаны для создания небольшой сложной библиотеки [43], что способствует разработке большего количества соединений для углубленных исследований взаимосвязи между структурой и деятельностью. Исследования показали, что внедрение гетероциклических соединений в натуральные продукты может значительно повысить биологическую активность и растворимость производных инструментов за счет принципа «фармакофорической комбинации» и увеличения количества водородных связей [44 — 45]. В настоящее время в многочисленных исследованиях сообщается об изменении производных женьшеня с гетероциклическим циклом. Среди них азотосодержащие гетероциклические соединения имеют низкую цитотоксичность и характеризуются хорошей растворимостью в воде, проницаемостью и биодоступностью.
Пиразолы представляют собой гетероциклические соединения на пять частей, состоящие из двух соседних атомов азота. Они имеют различные фармакологические действия, такие как противовоспалительные, антивирусные и антидепрессантные эффекты, и широко используются при разработке новых лекарственных средств [46]. Производные изоксазола также имеют различные биологические виды деятельности, такие как антибактериальные, антивирусные и антиопухолевые эффекты, и широко используются в органическом синтезе [47]. Исходя из этого, Dai В то же время- эл. - привет.[48] ввели скелет пиразола и изоксазола в положение с -3 дп, разработали и синтезировали 19 производных дп, содержащих гетероциклы (см. рис. 12), и изучили их антираспространенческую деятельность против четырех различных опухолевых клеток. Результаты показали, что продукты 86 и 87, полученные путем смешивания кольца PD с пизольным кольцом, имеют значительную антираковую активность. Например, 86 имеет IC50 в 14,15 ±1.13 μmol/L против клеток гэп2, а 87 имеет IC50 в 13,44 ±1.23 μmol/L против A549, что в четыре раза больше, чем PD. Он также оказывает большее ингибиторное воздействие на три других опухолевых клетки. Однако соединения 88 и 89a-89i имеют низкую растворимость в воде из-за наличия нескольких эфирных связей и гидрофобных групп, таких как ароматические кольца, что приводит к низкой активности против распространения опухолей. Замена эфирных облигаций в структурах производных 88 и 89a-89i облигациями амида для получения производных 90 - a - 90f не улучшила деятельность по борьбе с распространением опухолей. С другой стороны, результаты испытаний in vitro показали, что 87 > 86, 89a > 88, и 90a > 91, что указывает на то, что пизолированные производные PD, как правило, более активны, чем изоксазольные соединения.
Пиразин и пиримидиновые соединения проявляют широкий спектр биологических видов деятельности, и эти два типа структур часто встречаются в продаваемых на рынке молекулах лекарственных средств [49 — 50]. Ван и др. [51] гетероциклические соединения, такие как пиразин, оксадиазол, изоксазол, пиразил и пиримидин, были введены в позиции C-2 и C-3 PPD благодаря классическим органическим реакциям, таким как окисление, гидрогенация, конденсация клайзенэфира, сокращение выбросов, а также защита и дезащита гидроксильных групп. Был синтезирован ряд гетероциклических взрывателей 20(S) производных PPD (см. рис. 13), и была проведена оценка их ингибиторного воздействия на активатор рецептора для ядерного фактора-инвазивной лиганд (RANKL)- индуцированной дифференциации остеокласта. Соотношение "структура-активность" показывает, что по сравнению с ПДК, в дополнение к фенилпизольным производным, ингибирование дифференциации остеокласта оксадиазолом, изоксизолом и пизолом с пятью-членовыми гетероциклическими изменениями (93, 94 и 95а) имеет аналогичную или несколько более сильную ингибиторную активность (мк50 = 10,3 ингибиторного/л), чем ПДК; В то время как ингибиторная активность соединений, измененных с шестью-членовыми гетероциклическими кольцами, такими как пиразин и пиримидин (92,96а) значительно возросла.
На основе превосходной активности соединения 96a исследовательская группа дополнительно модифицировала производные пиримидина (см. диаграмму 14). Результаты показали, что при умеренной концентрации 1,0 μmol/L, большинство деривативов имели почти 100% ингибиторный эффект (за исключением 96f); При концентрации 0,1 гравмола/л эффект ингибирования модифицированных производных метила (96b) и этила (96c) значительно возрос, в то время как активность ингибирования модифицированных соединений метоксия (96d), этоксия (96e) и амино (96g) практически не изменилась. Кроме того, исследователи структурно модифицировали 96b с помощью боковой цепи с -12- гидроксид или с -17 (см. рис. 14). Результаты показали, что замена гидроксиловой группы на позиции с -12 группой кетона (98), оксима (99), грава-гидроксида (100) или ацетата (101) привела к значительному снижению ингибиторной активности. При концентрации 0,01 μmol/L 98-101 не проявлял практически никакого ингибиторного эффекта. Соединение 105 показало лучшую ингибиторную активность (IC50 = 11,8 nmol/L), даже при концентрации 0,01 μmol/L, что было лучше, чем активность PPD (IC50 = 10,3 μmol/L), и оно может ингибировать остеокластогенез как in vitro, так и in vivo.
2.4 модификация полимера
Гидрофилистические полимерно-модифицированные противомалярийные препараты могут не только компенсировать их низкую адресность, но и повысить растворимость воды, стабильность, in - привет, виво.период полураспада и биодоступность препарата [52]. В последние годы технология доставки наркотиков быстро развивается, что делает женьшень широко изучены. Lu В то же время- эл. - привет.[53] подготовили соединение Rh2 с водорастворимым o-карбоксимелом читосаном (O-CMC) (Rh2- conjuo -CMC, C,O-CMC/Rh2) (106) (см. рис. 15) через реакцию эстерификации. Результаты показали, что 106 были очень пористыми, а эфирные облигации в структуре чувствительны к pH. При pH/ч.5.8 скорость высвобождения Rh2 была выше на ранней стадии, поэтому скорость высвобождения Rh2 можно было контролировать в соответствии с изменениями pH на месте повреждения во время воспалительной боли. Сочетание o-карбоксимела читосана повысило биологическую эффективность Rh2 in vivo за счет повышения его растворимости, регулирования скорости его высвобождения и продления срока его действия в организме. Тем самым повышается биологическая эффективность Rh2 in vivo.
Полиэтиленгликоль (Пэг) обладает преимуществами простоты модификации, биоразлагаемости, биосовместимости и высокой скоростью инкапсуляции препарата и, таким образом, демонстрирует большие перспективы в поставке лекарств. 59. Mathiyalagan В то же время- эл. - привет.[54] комбинировали гидрофилическую привязку с гидрофобным Rh1 и Rh2 для синтеза двух видов пассивных целевых производных женьшеня при поставке (см. рис. 15). По сравнению с Rh1, PEG-Rh1 (107) обладает более высокой антиопухолевой активностью в клетках рака легких человека (A549), в то время как PEG-Rh1 и PEG-Rh2 не проявляют цитотоксичности в неинфицированных клетках мурин макрофаге (сырое 264.7). Среди них PEG-Rh2 (108) может значительно препятствовать производству оксида азота и, таким образом, демонстрировать лучшую противовоспалительную активность. Это свидетельствует о Том, что полимеры Пэг могут не только повысить растворимость женьшеня и уменьшить цитотоксичность, но и обеспечить целенаправленный выход благодаря повышению проницаемости и удержанию (орэд) и различным условиям pH.
2.5 сопутствующая модификация
Сообщается, что соединения ТПП обладают высокой способностью к точечной митохондрии и используются для выборочной доставки антиканцерологических препаратов, в Том числе адриамицина и цисплатина, в митохондрию опухолевых клеток [55]. В целях повышения целенаправленности и активности женьшеня 25-MeO-PPD, 25-OH-PPD и PD, Ma В то же время- эл. - привет.[56] ввели алкильные цепи различной длины на своих позициях C-3, а затем конджузированный трифенилфосфин (ТПП) в конце синтезировать ряд конджугатов женьшеня (см. рис. 16). Исследования по борьбе с распространением раковых клеток (A549, MCF-7) и обычных клеток (es -1) показали, что большинство соединений более активны, чем соответствующие исходные соединения, и демонстрируют более сильные ингибиторные эффекты в раковых клетках, чем в обычных клетках. Из них 109 могут аккумулироваться в митохондрии клеток MCF-7, стимулировать производство реактивных видов кислорода (рос), а также вызывать деполяризацию митохондриального мембранного потенциала, ведущую к апоптозу. Таким образом, 109 из них демонстрируют высокую избирательность и хороший антипролиферативный эффект (IC50 = 0,76 μmol/L) на клетки MCF-7.
2.6 прочие изменения
Помимо вышеупомянутых пяти методов, структурные изменения женьшеня также включают в себя этерификацию, алкиляцию, каталитическую гидрогенацию и гликозилирование [57-58]. Эфирификация и алкилация предполагают реакцию гидроксиловой группы женьшеня с галоалканами под катализатором щелочи. Каталитическая гидрогенация предполагает использование катализатора для непосредственного гидрогената ненасыщенной группы в мономерной структуре женьшеня к насыщенной группе. Гликозилляция предполагает включение соответствующих донорских групп, таких как маннозиловые, ксилозиловые и рхамнозиловые группы в гидроксиловую группу женьшеня. Например, Ren В то же время- эл. - привет.[59] представили доноров сахара к C-20 OH производных PPD путем окисления, сокращения, нуклеофилической замены и других реакций для подготовки серии производных женьшеня C-K с различными сахарными колецами [60-65].
3. Резюме
В настоящем документе рассматриваются методы структурной модификации женьшеня в последние годы. Он в основном использует органические кислоты, аминокислоты и неорганические кислоты для реакции с гидроксильными группами на C-3 и C-20 позиции aglycone и первичные гидроксильные группы на сахарной цепи женьшеня для получения эфирных производных, с тем чтобы улучшить растворимость липидов и биодоступность женьшеня. Исследования по взаимоотношениям структура-активность показали, что активность производных женьшеня после модификации эстерификации имеет следующие характеристики: ненасыщенные жирные кислоты > Насыщенные жирные кислоты, короткоцепные жирные кислоты > Длинноцепные жирные кислоты. Модификация сульфатов путем введения полярных групп, модификация окисления путем уменьшения ненасыщения или добавления ионоидных групп, таких как карбоксильные группы, гетероциклическая модификация путем увеличения числа водородных связей, а также гидрофильная сложная модификация-все это может в различной степени повысить растворимость в воде и биодоступность женьшеня и может значительно повысить биологическую активность этих производных. Эти методы модификации служат важным справочным материалом для исследования и разработки и применения женьшеня.
However, there are currently some deficiencies in the structural modification of ginsenosides: firstly, there are relatively few structural modification methods. Structural modification mainly involves introducing groups that can react with hydroxyl groups, making the sites and types of products of structural modification relatively simple, and leading to insufficient research on the structure-activity relationship. In particular, there is a relative lack of modification of the sugar chain. There are few reports on the replacement of the sugar chain and the splicing of the sugar chain essential for activity with other different types of aglycon or skeleton to enhance activity and broaden the scope of activity. Second, the lack of precision in structural modification results in low activity. Current research on the activity of ginsenoside derivatives mainly focuses on in vitro anti-tumor and anti-oxidant activities, and there is relatively little further research on in vivo activity, with very few compounds entering clinical research. Third, the research on the activity of ginsenoside derivatives is not in-depth enough. There is very limited research on ginsenosides and their derivatives with immunostimulatory activity as vaccine adjuvants. The few studies on ginsenoside adjuvants mainly use crude ginsenoside extracts, and there is a lack of systematic research on the potential application value of ginsenosides and their derivatives as potent immunostimulants in vaccine adjuvants.
В-четвертых, текущие структурные изменения в основном сосредоточены на женьшень даммаранского типа, с относительно небольшим количеством изменений к оланолиевой кислоте и женьшень орцинола типа. Поэтому будущие структурные изменения должны повысить точность введения групп и структур, расширить методы структурной модификации и модификации сайтов, расширить сферу применения производных женьшеня, и заложить теоретическую основу для разработки женьшень лекарства и продукты питания для здоровья.
Ссылка:
[1] хоу м, ван р, чжао с и др. Женьшень женьшень рода panax и их биосинтез [J].Acta pharmaceuticals Sinica - B,2021, 11 (7): 1813 — 1183.
[2]13. Вану- г,AI 1. Z- Y,Чжан (Китай)J D, В то же время- эл. - привет.Прогресс в исследовании антиопухолевой активности и механизма женьшень [J].Наука и техника пищевой промышленности, 2023, 44(1): 485 — 491.
[3]PAIk - с,SONG G - Y,JO E - к,В то же время- эл. - привет.Женьшень для терапевтического целеопределения воспаления через модуляцию окислительного стресса [J].Международная иммунофармакология, 2023, 121: 110461.
[4]Лю (LIU)F - X,LIN Z - X,Чжан (Китай)H L, В то же время- эл. - привет.Анализ механизма защиты от усталости и потенциальных целей женьшеня [J].China Журнал по темеof Chinese Materia Medica, 2019, 44(24): 5479-5487.
[5]ARRING N M, MILLSTINE D, MARKС. SL A, et al. Женьшень как средство от усталости: систематический обзор [J]. JAltern дополнение м. 2018, 24(7):624-633.
[6] фэн с, ли т, вей х, чжэн у и др. Антиоксидантные и антиусталостные эффекты редких женьшеня и гравитационной аминобутиновой кислоты в ферментированном женьшене и пропитанной коричневой рисовой пюре. Международный журнал молекулярных наук. 2024, 25(19):10359.
[7] ху В (1) - р, Гонконг (США) - г, Чжан (Китай) Z - г, et al. В. методы работы on 3. Улучшения of the poor Устный перевод Биодоступность женьшеня: предварительная обработка, структурная модификация, сочетание лекарственных средств и система микро-или нано-доставки [J]. Журнал женьшеня исследования, 2023, 47 (6): 694-705.
[8]FА вот и нет.Ч, ч, ч.FAN L, 13. ВанZ и др. Редкие женьшень: уникальный взгляд на женьшень исследований [J]. Журнал передовых исследований, 2024, https://doi.org/10.1016/j.jare.2024.01.003.
[9] сюй Ч, ч, ч.лю W, дуан C, и др. Подготовка и биоактивность редкого женьшеня Rg3 И Rh2: обновленный обзор [J]. Филадельфия, 2023, 167: 105514.
[10]LI S, LI - джей,ZHAO - Y,et al. Надмолекулярная интеграция многофункциональных наноматериалов с помощью азокаликсарена, декорированного маннозой, и женьшеносида Rb1 Для синергетической терапии ревматоидного артрита [J]. ACS Nano, 2023, 17 (24): 25468-25482.
[11] ян х, джин х, фу и др. Panax женьшень производство редких женьшень Rg3 И Rh2 от эндофитических бактерий из [J]. Журнал сельского хозяйства и пищевой химии, 2019, 67 (31): 8493-8499.
[12]XU X, QU W, JIA/данные отсутствуют.Z и др. Влияние возраста культивирования на противовоспалительную деятельность нового типа рыжего женьшеня [J]. Биомедицина и Фармакотерапия, 2021, 136: 111280.
[13] беднарчик-квинар б, ле граукова, щука I и др. Влияние олеанолиевой кислоты и ее четырех новых полусинтетических производных на клеточные линии mewo и a375 меланомы человека [J]. Фармацевтика, 2023, 16 (5): 746.
[14]DENG X, KE - джей,- чжэн!- Y,et al. Α synthesis И оценка биоактивности олеанолика Производные кислотного окислителя, такие как-глюкозидазы и-амилазы-ингибиторы [J]. Журнал ингибирования фермента и медицинской химии, 2022, 37 (1): 451-461.
[15] цао и, ван к, ван джей и др. Проектирование, синтез и антибактериальная оценка производных окотиллола с полициклическими азотосодержащими группами [J]. Будущее лекарственная химия, 2021, 13 (12): 1025-1039.
[16] лю джей, ган х, ли т и др. Метаболиты и пути биотрансформации in vivo после перорального введения окотиллола [J]. Биомедицинская хроматография, 2020, 34 (8): э4856.
[17] чжан D, Цао (CAO) - Y, WANG - к, et al. - дизайн, - синтез, and 3. Антибактериальные средства Iii. Оценка О чем ты? Ocotillol производные и их синергетический эффект с обычными антибиотиками [J]. Молекулы, 2021, 26 (19): 5969.
[18] тонг - Y,сон X, чжан уи др. Анализ структурных изменений, биологической активности, соотношения структура-активность производных женьшеня типа PPD [J]. Фитотерапия, 2022, 158: 105135.
[19] го - г,XING Y, Солнце и Солнце Y, et al. Женьшень (женьшень) derivatives synthesized Из российской федерации 20(R)-panaxotriol: Синтез, характеристика и антиопухолевая активность, направленная на траекторию HIF-1 [J]. Журнал женьшеня исследования, 2022, 46 (6): 738-749.
[20]HU Q, HONG H, ZHANG Z и др. Методы улучшения низкой биодоступности женьшеня при ротовой полости: предварительная обработка, структурная модификация, сочетание лекарственных средств и система микро-или нано-доставки [J]. Журнал женьшеня исследования, 2023, 47 (6): 694-705.
[21] Юлия - джей, 1. Даи Y L, ZHENG F, F, et al. Устный перевод Покрытие за счет имеющихся ресурсов and in vivo B. биотрансформация Женьшень [J]. Китайский журнал биологических наук, 2014, 27(12):1633 — 1636.
[22] лян дж., тан х, ван с и др. Изменение структуры женьшеня Rh2 И цитостатическая активность на раковых клетках [J]. Оао омега, 2023, 8 (19): 17245-17253.
[23]LI K K, YAN X M, LI Z N, et al. Синтез и антиопухолевая активность трех новых женьшень M1 Деривативы с 3 '- эфирными изменениями [J]. Биохимия, 2019, 90: 103601.
[24]HUANG Y, LI H M, ZHANG Y X и др. Синтез и биологическая оценка производных женьшенозида K как нового класса LXR α activator [J]. Молекулы, 2017, 22 (7): 1232.
[25] ван р, ли м, лю м и др. Характеристика эмульсии пикеринга с помощью модифицированного крахмала и крахмала a Потенциал для доставки В капсулах Биоактивное соединение [J]. Международная организация труда Журнал по теме of Биологические макромолекулы, 2023, 231: 123164.
[26] сан ки р, тимонти дж., казутоши и др. Влияние перорального астаксантина prodrug (CDX-085) на уровень липопротеина и прогрессирование атеросклероза у LDLR -/- и apoe -/- мышей [J]. Атеросклероз, 2012, 222.
[27] Кристофер т. с., удаянаф а., Кристофер в. и др. Таргетирование проинвазивных онкогенов короткоцепными жирными кислотно-гексаминными аналогами препятствует мобильности метастатических клеток рака молочной железы mda-mb-231 [J]. Журнал медицинской химии, 2008, 51:8135-8147.
[28] чжан джей, тонг Y, Лу X и др. Производный женьшеня C-K и его ингибиторное воздействие на гепатоцеллюлярный Рак [J]. Науки о жизни, 2022, 304: 120698.
[29] сяо с, линь, ван х и др. Оценка синтеза и цитотоксичности производных панаксадиола [J]. Химия и фармацевтика Биоразнообразие, 2020, 17 (1): e1900516.
[30] юань W, го - джей,ван X, и др anti-tumor activity Iii. Оценка [J]. Стероиды, 2018, 129: 1-8.
[31] лин л, чжао и, ван п и др. Аминокислотные производные женьшеня AD-2 вызывают гепг2 клеточный апоптоз, воздействуя на цитоскелет [J]. Молекулы, 2023, 28 (21): 7400.
[32] миямото - т, 1. Тогава K, - хигучи. - р, et al. Шесть из них В настоящее время Число выявленных нарушений С точки зрения биологии active Тритерпеноиды гликозидные сульфаты из морского огурца cucurnaria echinata [J]. Либигс аннален дер химия, 1989 1990 (5):453-460.
[33] го з, ван л, хак с и др. Оценка In-vitro иммунологической активности модифицированного сульфатом дериватива женьшеня -3 [J]. Границы ветеринарной науки, 2023, 10: 1068315.
[34] фу - B, B. Би W, - он... C, et al. На основе сульфата derivatives of 20(S)- женьшень Rh2 and their inhibitory effects По ЛПС спровоцированные воспалительные цитокины и посредники [J]. Филадельфия, 2013, 84: 303 — 307.
[35]B. БиW, FU B, Организация < < шен > >H и др. Сульфатная производная 20(S)- Rh2 женьшеня Ингибирует воспалительные цитокины через каналы mapks и nf-kappa b в вызываемых ЛПС RAW264.7 macrophages [J]. Воспаление, 2012, 35: 1659 — 1668.
[36] пгу, BI W, SHEN H, et al. Ингибиторий (ингибиторий) effects of На основе сульфата 20(S)-ginsenoside Rh2 on the release of Провоспалительные посредники в сырых клетках, вызванных ЛПС [J]. Европейский журнал фармакологии, 2013, 712: 60 — 66.
[37]ZHOU W X, YANG N, ZHAO Y Q. достижения в исследованиях по повышению растворимости женьшеня в воде [J]. Оценка наркотиков, 2016, 39(2): 322 — 327.
[38] вонг V, Дон H, лян X и др. Rh2E2, новый метаболический подавитель, специально ингибирует энергетический метаболизм опухолевых клеток [J]. Oncotarget and Therapy, 2016, 7 (9): 9907-9924.
[39] Солнце X, клык X J, гао м и др. Взаимосвязь между синтезом и структурой деривативов пиксинола как новых противовоспалительных агентов [J]. Медицинская химия оао, 2020, 11, 457-463.
[40] юань Y, В то время как X, На английском языке Y, et al. - дизайн, - синтез, and anti-inflammatory activities of 12- дегидропиксинол производные [J]. Молекулы, 2023, 28 (3): 1307.
[41] ян г, ми х, ван и др. Слияние михаилоакцепторов повышает противовоспалительную активность женьшенозидов как потенциальных модуляторов NLRP3 Путь к сигналу [J]. Биоорганическая химия, 2023, 134:106467.
[42] чжан Y м, юань W H, ван X D и др. Синтез, характеристика и оценка цитотоксической активности гинзенгдиокисления и гибридных производных азота [J]. Медхемком, 2018, 9(11): 1910 — 1919.
[43] сяо с, ван х, сюй л и др. Новые производные женьшеня показали свое воздействие на клетки PC-3, вызывая g1 - фазовый арест и химически активные образцы кислорода-опосредованный клеточный апоптоз [J]. Биоорганическая химия, 2021, 112: 104864.
[44] ян г к, лю с, чжан с и др. Обнаружение производных пиксинола амида, содержащих остатки аминокислоты в качестве несубстрата Спластерик (сплав) 2. Ингибиторы С помощью p- гликопротеина Мультинаркотические средства - сопротивление; [J]. Journal of Лекарственная химия, 2023, 66 (13): 8628-8642.
[45]MA/данные отсутствуют.L, MIAO D, LEE J, et al. Синтез и биологическая оценка гетероциклических кольцевых взрывающихся производных женьшеня женьшенового типа в качестве потенциальных противоопухолевых агентов [J]. Биоорганическая химия, 2021, 116: 105365.
[46] карручи к, ради, рамли и др. Синтез и фармакологическая деятельность производных пиразола: обзор [J]. Молекулы, 2018, 23(1):134.
[47]WANG J, WANG D B, SUI L L, И др. Естественные продукты-изоксазольные гибриды: обзор изменений в медицинской химии [J]. Арабский журнал химии, 2024, 17(6):105794.
[48]DAI R, WEI X, LI T и др. Синтез и антиопухолевая активность панксадиола пиразола и изооксазола производных [J]. Химия и фармацевтика Биоразнообразие, 2023, 20 (8): e202300507.
[49]HOU W, DAI W, HUANG H и др. Фармакологическая активность и механизм пиразинов [J]. Европейский журнал медицинской химии, 2023, 258:115544.
[50] рашид H - с, Организация < < мартинес > > С. О. A - с, - добрый вечер. A - п, et al. В. научные исследования Ii. События in the Синтезы, противовоспалительные действия и отношения "структура-активность" пириминов [J]. РСК вперед. 2021, 11(11): 6060-6098.
[51] ван S, ZHANG J, ZHANG J, et al. Ii. Обобщение and biological Iii. Оценка of - гетероциклик Ржавые взрыватели 20(s)- производные протопанакадиола в качестве мощных антиостеопорозных агентов [J]. Журнал медицинской химии, 2023, 66 (17): 11965-11984.
[52] ян к, ян ц, ю г и др. Полипронаркотические наномедицина: формирующаяся парадигма терапии рака [J]. Передовые материалы, 2022, 34 (6): e2107434.
[53] Лу H, Екс (екс) J, В чем дело? Y, et al. Iii. Оценка of the anti-inflammatory Боль от боли Воздействие на окружающую среду of Женьшень-конфузированные o- карбоксимельные частицы читосана [J]. Полимеры, 2023, 15 (19): 4011.
[54]MATHIYALAGAN R, WANG C, KIM Y, et al. Подготовка полиэтиленгликоль-женьшеносидного Rh1 И Rh2 соединяет и их эффективность против рака легких и воспаления [J]. Молекул, 2019, 24 (23): 4367.
[55]BATHEJA S, GUPTA S, TEJAVATH K K, et al. Конджугейты на базе ТПС: потенциальный выбор в качестве мишени лигандов [J]. Открытие лекарства сегодня. 2024, 29(6):103983.
[56]MA L, WANG X, LI W,et al.Rational Проектирование, синтез и биологическая оценка трифенилфосфония-женьшенозида - да, конечно. as Цель-митохондрия anti-cancer В качестве агентов [J]. Биохимия, 2020, 103: 104150.
[57] чжан х р, е ак, чжан у у и др. Прогресс в области исследований дериватизации женьшеня и ее биологической деятельности [J]. Китайские традиционные и травяные препараты, 2022, 53(14): 4554-4567.
[58] юань S - Z, WANG B, Париж (Франция) X, et al. Прогресс в исследованиях по биотрансформации редких женьшень [J]. Наука и техника пищевой промышленности, 2023, 44(12): 480-489.
[59]RRN S, LIU R, WANG Y и др. Синтез и биологическая оценка аналогов соединения K женьшеня как нового класса антиастматических агентов [J]. Биоорганическая и Письма по медицинской химии, 2019, 29 (1): 51 — 55.
[60]REN G, LV W, DING Y и др. Женьшень сапонин метаболит 20(S)- протоанаксадиол снимает фиброз легких путем многоцелевых сигнальных путей [J]. Журнал женьшеня, 2023, 47 (4): 543-551.
[61] чжан х, чжан л, ян с и др. Профилактический эффект протопанаксадиола типа сапонинов и протопанаксатриола типа Организация < < сапонины > > on - миелоподавление. Мыши и мыши induced by - циклопохоспид [J]. 1. Границы В фармакологии, 2022, 13: 845034.
[62]KIM A, PARK SM, KIM NS, et al. Женьшень Rc, активный компонент женьшеня panax, смягчает окислительную стресс-индуцированную мышечную атрофию путем улучшения митохондриального биогенеза [J]. Антиоксиданты, 2023, 12 (8).
[63]LI S, LI JJ, ZHAO YY, et al. Надмолекулярная интеграция многофункциональных наноматериалов с помощью азокаликсарена, декорированного маннозой, и женьшеносида Rb1 Для синергетической терапии ревматоидного артрита [J]. ACS Nano, 2023, 17 (24): 25468-25482.
[64]LEE H, KONG G, TRAN Q, et al. Отношения между женьшень Rg3 И метаболический синдром [J]. Границы в фармакологии, 2020, 11: 130
[65] чэнь Y Y, LIU В (1) - п, AN - п, et al. Женьшень (женьшень) Rd: рд: A Перспективы на будущее natural Средства для защиты организма agent [J]. Фитомедицин, 2022, 95: 153883.
-
Предыдущий
Какой метод извлечения женьшеня?
-
Следующий проект
Что такое женьшень Rh2 и его производное?


 Английский язык
Английский язык Французский язык
Французский язык На испанском языке
На испанском языке Русский язык
Русский язык Корейская народно-демократическая республика
Корейская народно-демократическая республика На японском языке
На японском языке